Основные характеристики и законы молекулярно-кинетической теории идеального газа
Молекулярно-кинетической теорией называется учение, объясняющее свойства тел взаимодействием и движением молекул. Основные ее положения таковы:
1. Все тела состоят из мельчайших частиц - атомов и молекул.
2. Между атомами и молекулами существуют силы взаимодействия, которые обнаруживаются на расстояниях, сравнимых с размерами молекул. Взаимодействие существенно зависит от типа молекул и расстояний между ними.
3. Атомы и молекулы находятся в состоянии непрерывного хаотического движения.
Рассмотрим газообразное состояние вещества, которое характеризуется четырьмя величинами: массой - т, объемом - V , давлением - Р и температурой Т. Все эти величины в газообразном состоянии вещества зависят друг от друга и при изменении одной из них, вообще говоря, меняются все остальные. Простейшими свойствами обладает газ, взаимодействие между молекулами которого пренебрежимо мало. Такой газ называется идеальным. Всякий реальный газ при достаточном разрежении близок по своим свойствам к идеальному. Некоторые газы, такие, как воздух, азот, кислород, даже при обычных условиях, т.е. при комнатной температуре и атмосферном давлении, мало отличаются от идеального газа. Формула, закономерно связывающая характеристики газообразного состояния вещества, называется уравнением состояния идеального газа или уравнением Менделеева-Клапейрона и записывается:
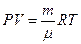 (3.22)
(3.22)
где R - универсальная газовая постоянная (R = 8,31 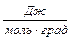 )
) 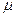 - масса моля. Моль - единица измерения количества вещества в системе СИ. Моль — количество вещества, масса которого в граммах равна его относительной молекулярной массе. В моле любого вещества содержится одинаковое число молекул NA =6,02·1023
- масса моля. Моль - единица измерения количества вещества в системе СИ. Моль — количество вещества, масса которого в граммах равна его относительной молекулярной массе. В моле любого вещества содержится одинаковое число молекул NA =6,02·1023 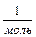 (число Авогадро).
(число Авогадро).

Основным уравнением кинетической теории газов называют уравнение, устанавливающее связь между давлением газа, его объемом и энергией. Для идеального газа мы допускаем отсутствие взаимодействия молекул, а следовательно, энергия газа является только кинетической энергией движущихся молекул. Простейшие рассуждения приводят к тому, что давление газа P= 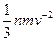 , где п - число молекул в единице объема; т — масса молекулы; v — средняя скорость молекулы. Учитывая, что кинетическая энергия поступательного движения молекулы
, где п - число молекул в единице объема; т — масса молекулы; v — средняя скорость молекулы. Учитывая, что кинетическая энергия поступательного движения молекулы 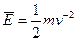 , можем записать предыдущее выражение в виде:
, можем записать предыдущее выражение в виде:
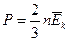 (3.23)
(3.23)
Уравнение (3.23) называется основным уравнением молекулярно-кинетической теории идеального газа. Основное уравнение позволяет сделать ряд выводов:
1. Произведение давления газа на его объем (для данной массы газа при постоянной температуре) есть величина постоянная, равная кинетической энергии непрерывного хаотического поступательного движения молекул, т.е.
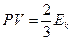
 (3.24)
(3.24)
2. На основании формул (3.22) и (3.24) получаем, что кинетическая энергия идеального газа Ек прямо пропорциональна абсолютной температуре Т:
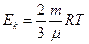 (3.25)
(3.25)
Кинетическая энергия одной молекулы будет:
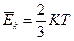 , (3.26)
, (3.26)
где К = 1,38-10 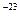 Дж/град. Эта зависимость позволяет вычислить скорости газовых молекул при заданной температуре: среднеквадратичную, среднеарифметическую и вероятную:
Дж/град. Эта зависимость позволяет вычислить скорости газовых молекул при заданной температуре: среднеквадратичную, среднеарифметическую и вероятную:
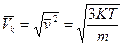 ,
, 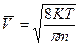 и
и 

3.Кинетическую энергию движения частиц, также как и температуру, можно рассматривать как меру теплового движения.
Учитывая выражение (3.26), получим зависимость 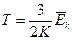 ,т.е. температура есть количественная мера энергии теплового движения молекул, из которых состоит тело. Определенная из этого условия шкала температур называется термодинамической (шкалой Кельвина).
,т.е. температура есть количественная мера энергии теплового движения молекул, из которых состоит тело. Определенная из этого условия шкала температур называется термодинамической (шкалой Кельвина).
Основные понятия и законы термодинамики
Раздел физики, изучающий тепловые явления в области макротел с точки зрения происходящих в них процессов взаимного превращения теплоты и других видов энергии, называется термодинамикой. Термодинамика не касается микропроцессов, лежащих в основе этих превращений. Этим термодинамический метод исследования явлений отличается от рассмотренного выше молекулярно-кинетического, или статистического метода.
 Тело или совокупность тел, условно выделенных из окружающей среды для более удобного рассмотрения происходящих в них процессов, которые могут обмениваться между собой, а также с внешней средой энергией и веществом, называют термодинамической системой. Классическая термодинамика рассматривает преимущественно изолированные системы, т.е. системы, которые не обмениваются энергией с окружающей средой. При неизменных внешних условиях в изолированной системе устанавливается равновесное состояние, при котором макропараметры системы (температура, давление, объем) сохраняют постоянное значение сколь угодно долго. Например, газ, находящийся в закрытом сосуде, при постоянном объеме и равномерно распределенных давлении и температуре может сохранять это состояние сколь угодно долго; жидкость в закрытом сосуде при постоянной температуре сохраняет равновесное состояние с образовавшимся над ее поверхностью насыщенным паром. Изолированная система, находящаяся в неравновесном состоянии, самопроизвольно переходит в равновесное. Переход системы из одного состояния в другое, происходит через ряд промежуточных состояний, и называется термодинамическим процессом. Например, если в начале температура и давление в объеме газа были распределены неравномерно, то с течением времени они самопроизвольно уравниваются во всех его частях. Процесс, который
Тело или совокупность тел, условно выделенных из окружающей среды для более удобного рассмотрения происходящих в них процессов, которые могут обмениваться между собой, а также с внешней средой энергией и веществом, называют термодинамической системой. Классическая термодинамика рассматривает преимущественно изолированные системы, т.е. системы, которые не обмениваются энергией с окружающей средой. При неизменных внешних условиях в изолированной системе устанавливается равновесное состояние, при котором макропараметры системы (температура, давление, объем) сохраняют постоянное значение сколь угодно долго. Например, газ, находящийся в закрытом сосуде, при постоянном объеме и равномерно распределенных давлении и температуре может сохранять это состояние сколь угодно долго; жидкость в закрытом сосуде при постоянной температуре сохраняет равновесное состояние с образовавшимся над ее поверхностью насыщенным паром. Изолированная система, находящаяся в неравновесном состоянии, самопроизвольно переходит в равновесное. Переход системы из одного состояния в другое, происходит через ряд промежуточных состояний, и называется термодинамическим процессом. Например, если в начале температура и давление в объеме газа были распределены неравномерно, то с течением времени они самопроизвольно уравниваются во всех его частях. Процесс, который
может самопроизвольно протекать как в прямом, так и в обратном направлениях, называется обратимым. Обратимый процесс состоит из последовательного ряда равновесных состояний. Такой процесс является идеализированным. К нему приближаются процессы, протекающие настолько медленно, что каждое из промежуточных состояний успевает достаточно приблизиться к равновесному. Эти процессы называются квазистатическими и к ним можно отнести, например, все достаточно медленно протекающие процессы сжатия, расширения, нагревания и охлаждения газа. Необратимым называется процесс, в котором хотя бы одно промежуточное состояние не является равновесным и процесс нельзя провести в обратном направлении через те же промежуточные состояния. Необратимыми являются, например, быстро протекающие процессы сжатия, расширения, нагревания и охлаждения газа. По природе необратимыми процессами являются расширение газа в высокий вакуум, взаимная диффузия газов (или любых веществ), передача теплоты путем теплопроводности и другие.
В основе термодинамики лежат два закона (исторически названные началами), в которых, подобно закону сохранения энергии, подытожен многовековой, опыт трудовой деятельности человека. Первое начало устанавливает количественные соотношения при превращении теплоты в механическую работу (или другие виды энергии). Второе начало указывает направленность соответствующих процессов. Первый закон термодинамики записывается в дифференциальной форме: 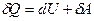 и читается: количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершаемую системой работу против внешних сил. Первый закон термодинамики по сути является законом сохранения и превращения энергии для термодинамического процесса. Внутренняя энергия тела (системы) - энергия данного тела (системы), зависящая только от его внутреннего состояния. С молекулярно-кинетической точки зрения, внутренняя энергия определяется суммой кинетической энергии отдельных молекул и энергией взаимодействия между ними. Изменение внутренней энергии dU не зависит от процесса и определяется параметрами начального и конечного состояния; напротив
и читается: количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершаемую системой работу против внешних сил. Первый закон термодинамики по сути является законом сохранения и превращения энергии для термодинамического процесса. Внутренняя энергия тела (системы) - энергия данного тела (системы), зависящая только от его внутреннего состояния. С молекулярно-кинетической точки зрения, внутренняя энергия определяется суммой кинетической энергии отдельных молекул и энергией взаимодействия между ними. Изменение внутренней энергии dU не зависит от процесса и определяется параметрами начального и конечного состояния; напротив 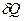 и
и 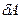 зависят от процесса перехода из начального в конечное состояния.
зависят от процесса перехода из начального в конечное состояния.
Полная работа А, совершаемая газом (системой) определяется

путем интегрирования: 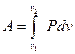 . Результат интегрирования будет
. Результат интегрирования будет
зависеть от характера зависимости между давлением и объемом газа. Различают четыре основных процесса изменения состояния идеального газа: изохорический, изобарический, изотермический и адиабатический.
Закон сохранении энергии устанавливает взаимопревращаемость ее различных видов, но не указывает, имеется ли при этом какая-либо преимущественная направленность. Опыт показывает, что в естественных процессах такая направленность существует. Например, любые виды энергии могут самопроизвольно и полностью переходить в теплоту, тогда как теплота может быть превращена в другие виды энергии только с помощью машин, аппаратов, т.е. при наличии соответствующих изменений в окружающих телах, и при этом не полностью, так как процесс, преобразования связан с неизбежными потерями части теплоты, которая передается окружающим телам. При теплообмене теплота самопроизвольно переходит только от тел с более высокой температурой к телам с более низкой температурой (второй закон термодинамики). Для того чтобы осуществить переход теплоты от менее нагретого тела к более нагретому, как это имеет место, например, в холодильниках, требуются довольно сложные процессы, для осуществления которых необходимо затратить дополнительную энергию.
Тепловой машиной называется устройство, в котором , внутренняя энергия топлива превращается в механическую работу.
Учитывая второй закон термодинамики, схематически холодильную и тепловую машины можно представить, как показано на рис. 1 при 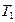 >
> 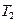 .
.
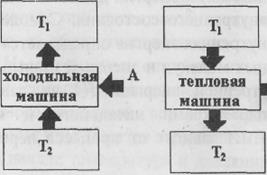 Рис. 1
Рис. 1
|

Примером тепловых машин являются установки на тепловых электростанциях, где внутренняя энергия нефти, угля и газа превращается в механическую работу, за счет которой вырабатывается электрическая энергия. В качестве термоаккумуляторов (теплоносителей) при теплообмене используются кирпичная или каменная печь, нагретая вода, нагретый песок и другие вещества.
Опыт показывает также, что чем выше температура тела теплоносителя по отношению к температуре окружающих тел, тем легче и с меньшими потерями можно преобразовать содержащуюся в нем теплоту в другие виды энергии, а коэффициент полезного действия тепловых машин можно выразить так: 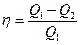 , который для идеального термодинамического процесса в цикле Карно будет:
, который для идеального термодинамического процесса в цикле Карно будет: 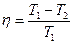 где
где 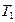 - температура нагревателя, а
- температура нагревателя, а 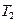 – температура холодильника тепловой машины. Также известно, что практически невозможно преобразовать в другие виды энергии теплоту, распределенную (рассеянную) между телами с равномерной, относительно низкой температурой. Рассеянная теплота является для человека бесполезной, как, например, то громадное количество теплоты, которое содержит вода морей и океанов при температуре мало отличающейся от температуры окружающих тел. Для характеристики степени «полезности» теплоты в этом отношении, а также количественной оценки неизбежных потерь при преобразовании теплоты, содержащейся в данной системе тел, в работу или другие виды энергии пользуются величиной
– температура холодильника тепловой машины. Также известно, что практически невозможно преобразовать в другие виды энергии теплоту, распределенную (рассеянную) между телами с равномерной, относительно низкой температурой. Рассеянная теплота является для человека бесполезной, как, например, то громадное количество теплоты, которое содержит вода морей и океанов при температуре мало отличающейся от температуры окружающих тел. Для характеристики степени «полезности» теплоты в этом отношении, а также количественной оценки неизбежных потерь при преобразовании теплоты, содержащейся в данной системе тел, в работу или другие виды энергии пользуются величиной 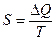 , называемой энтропией.
, называемой энтропией.
Изменение энтропии определяет обратимость или необратимость процессов, протекающих в изолированной системе. Так, при обратимых процессах в изолированной системе не количество теплоты, а энтропия остается неизменной: 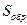 = const и
= const и 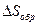 = 0. Все реальные процессы в газах, происходящие достаточно быстро, не говоря уже о любых термодинамических процессах с потерей энергии, необратимы и, следовательно, протекают с увеличением энтропии:
= 0. Все реальные процессы в газах, происходящие достаточно быстро, не говоря уже о любых термодинамических процессах с потерей энергии, необратимы и, следовательно, протекают с увеличением энтропии: 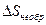 >0.
>0.
Таким образом, энтропия может рассматриваться как мера вероятности состояния термодинамической системы, а возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния.
Первые два начала термодинамики дают недостаточно сведений

о поведении термодинамических систем при нуле Кельвина. Они дополняются третьим началом термодинамики, или теоремой Нернста-Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина 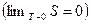
Передача внутренней энергии от одного тела к другому без совершения работы называется теплопередачей (или теплообменом). Передача тепла осуществляется с помощью процессов, происходящих на молекулярном уровне, в частности путем теплопроводности и теплового излучения. Передача теплоты путем теплопроводности происходит между любыми телами — твердыми, жидкими или газообразными, одинаковой или различной природы, при непосредственном соприкосновении или через любую промежуточную среду, но не через вакуум, в котором нет частиц вещества. Это явление в природе так же универсально, как и тепловые движения самих частиц. Передача теплоты путем теплопроводности подчиняется закону Фурье: количество теплоты 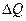 , проходящее за промежутки времени
, проходящее за промежутки времени 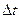 , через взятую внутри тела площадку
, через взятую внутри тела площадку 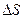 , перпендикулярную направлению распространения теплоты, пропорционально времени
, перпендикулярную направлению распространения теплоты, пропорционально времени 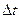 , площади
, площади 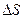 и градиенту температуры
и градиенту температуры 
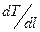 , вдоль рассматриваемого направления:
, вдоль рассматриваемого направления:
 .
.
где 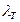 - коэффициент теплопроводности.
- коэффициент теплопроводности.
Теплопроводность различных веществ отличается в весьма широких пределах. Наименьшую теплопроводность имеют газы, в частности воздух. Вещества с низкой теплопроводностью называют теплоизолирующими. К ним относятся главным образом пористые вещества, содержащие воздух (пробка, шерсть, войлок и др.) Теплопроводность тканей человеческого организма различна. У жидких частей организма (тканевая жидкость, плазма крови и др.) она близка к теплопроводности воды. Теплопроводность плотных тканей значительно ниже, особенно у жировой ткани и наружного рогового слоя кожи. Кожа и подкожная жировая клетчатка являются для организма теплоизолирующим слоем.
Ниже приведены значения коэффициентов теплопроводности для комнатной температуры в Вт/(м К): воздух - 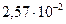 ; азот -
; азот - 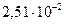 ;
;

кислород - 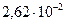 ; углекислый газ -
; углекислый газ - 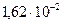 ; бумага -
; бумага - 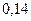 ; дерево -0,6; кирпич — 0,7; медь — 391; алюминий — 209; серебро — 418,7.
; дерево -0,6; кирпич — 0,7; медь — 391; алюминий — 209; серебро — 418,7.
Передача теплоты путем теплопроводности в жидких и газообразных средах значительно ускоряется при взаимном перемещении (перемешивании) нагретых и холодных масс среды. Это явление называется теплопередачей при конвекции. При естественной конвекции взаимное перемещение частиц среды происходит вследствие различных плотностей: нагретые частицы, как более легкие поднимаются вверх, холодные опускаются вниз на их место. Теплопередача при конвекции представляет собой весьма распространенное явление в природе, а также широко используется человеком в различных бытовых устройствах. Путем конвекции, например, значительно ускоряется приготовление пищи при одностороннем нагревании сосуда, выравнивается температура воздуха в помещениях, обогреваемых печами или радиаторами центрального отопления. Принудительная конвекция или циркуляция воды используется при устройстве центрального водяного отопления домов и другие.
Теплообмен посредством излучения может происходить как через промежуточную вещественную среду, если она прозрачна для излучения, так и через вакуум. Тепловое излучение свойственно всем телам без исключения и происходит при температурах, отличных от абсолютного нуля, в соответствии с законом Планка.
Дата добавления: 2015-08-11; просмотров: 1489;
