Составление уравнений химических реакций
Упражнения:
1.Атом, какого элемента имеет наибольший радиус?
а ) С б ) В в ) О г ) F
- У какого из перечисленных элементов наибольшее сродство к электрону?
а ) О б ) S в ) Se г ) Те
- Какой из гидроксидов проявляет наиболее сильные основные свойства?
а)Be(OH)2 б)LiOH в)Mg(OH)2 г)NaOH - Для какого элемента справедливо уравнение реакции:
ЭО3 + Н2О ↔ Н2ЭО4
i. а ) Р б ) I в ) С г ) S
- С какими из ниже перечисленных веществ будет реагировать серная кислота, Напишите уравнения реакций: 1) SO2, 2)ZnO, 3)Mg, 4) Ba(OH)2, 5) HCl, 6) Fe2O3, 7) P2O5
i. Ответы: 1- б ) В; 2- а ) О; 3- г)NaOH; 4- г ) S; 5-2)ZnO, 3)Mg, 4) Ba(OH)2, , 7) Fe2O3.
Уравнения реакций:
2)ZnO + H2SO4 = Zn SO4 + H2О
3)Mg+ H2SO4 = Mg SO4 + H2
4) Ba(OH)2+ H2SO4 = ВаSO4 + 2H2О
7) Fe2O3+ 3H2SO4 = Fe2 (SO4)3+ 3H2О
Лекция 4. Химическая связь
Основные виды химической связи. Ковалентная связь и ее свойства . Ионная связь и ее свойства.Водородная связь и ее свойства. Комплементарность. Металлическая связь и ее свойства.
4.1.Основные виды химической связи.Под химической связью понимают результат взаимодействия двух и более атомов, приводящий к образованию устойчивой многоатомной системы.
Важнейшими видами химической связи являются: ковалентная, ионная водородная, металлическая, межмолекулярная.
4.2.Ковалентная связь и ее свойства.
Ковалентная связь является наиболее универсальной в том плане, что ей подчиняется подавляющее большинство веществ как органических, так и неорганических. Суть ковалентной связи по методу валентных связей (ВС) заключается в том, что атомы, объединяя свои неспаренные валентные электроны с антипараллельными спинами в общую электронную пару, образуют более сложную частицу.
 .
.
Электронную пару по методу ВС обозначают двумя точками или чёрточкой - валентным штрихом. Ковалентная связь имеет пять основных свойств:
1. Энергия связи – выделенная атомами потенциальная энергия при образовании ими более сложных частиц.
При сближении двух атомов водорода максимально выделяется 435 кДж/моль. Это и является энергией молекулы водорода. Такой энергии соответствует максимально прочная молекула водорода. Энергия ковалентной связи лежит в пределах 150 ÷ 1000 кДж/моль. Чем выше энергия, тем прочнее частица.
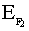 =150кДж/моль
=150кДж/моль
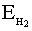 =435кДж/моль
=435кДж/моль
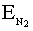 = 970 кДж/моль.
= 970 кДж/моль.
2. Длина связи – расстояние между центрами двух атомов, которое соответствует максимально потерянной потенциальной энергии, и сложная частица является наиболее прочной. Таким образом, длина связи тесно связана с энергией. Для атома водорода длина связи составляет 0,74 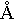 . Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга. Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
. Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга. Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
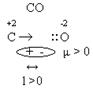
3. Полярность. Ковалентные частицы могут быть полярными и неполярными. Полярная ковалентная связь возникает в том случае, если частица образованна атомами с различными электроотрицательностями. В молекуле возникают два поля – диполи (+ ; -), между которыми есть какое-то расстояние. Диполь определяется дипольным моментом, который равен заряду электрона, умноженному на дипольное расстояние: μ = е • l. Размерность дипольного момента Кулон/метр (Кл/м). Чем больше разница между электроотрицательностью элементов, тем больше дипольный момент сложной частицы, т.е. тем полярней диполь. Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковой электроотрицательностью. В ковалентных неполярных частицах общая электронная пара принадлежит одинаково ядрам обоих атомов.Расстояние между "+" и "–" равно нулю. Дипольный момент тоже равен нулю. Полярность связи и полярность частиц не всегда совпадают между собой.
| 
| 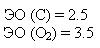
|
Полярность – векторная величина. Вектор всегда направлен от менее электроотрицательных элементов к более электроотрицательным элементам.
В молекуле СО2 два вектора, равные по величине, но противоположные по направлению, компенсируют друг друга, и молекула оказывается неполярной при полярной связи.
4. Насыщаемость ковалентной связи заключается в том, что все неспаренные валентные электроны обязаны участвовать в образовании сложных частиц.
5. Направлентность ковалентной связи заключается в том, что ковалентные частицы имеют определённую пространственную конфигурацию.
Пространственная конфигурация отдельной частицы определяется количеством σ – связей и их взаимным расположением в пространстве.
σ- связями называются связи, у которых область повышенной электрической плотности располагается на линии, связывающей ядра двух атомов.
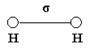
σ – связь - это первичная связь. Она является прочной и трудно разрывается. π – связью называется та связь, при которой обе повышенные электрические плотности располагаются выше и ниже линии, связывающей ядра двух атомов. π – связь всегда вторична и менее прочна, чем σ – связь. При образовании молекулы водорода перекрываются 2S – облака, и образуется одна σ – связь. Возникает линейная молекула с нулевым валентным углом.
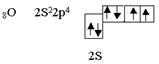
Такие же частицы, т.е. линейные с нулевым валентным углом, образуются при перекрывании двух рх – облаков, при образовании, например, молекул хлора или фтора. Такие же частицы образуются при перекрывании S- и p-облаков (например, HCl). Рассмотрим элемент шестой группы таблицы Менделеева - кислород.
 .
.
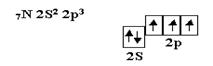
Кислород является центральным атомом в молекуле воды. Из шести валентных электронов атомов кислорода - два неспаренных. в пространстве возникают две σ–связи, расположенные друг к другу под теоретическим углом 90°. В молекуле воды угол равен 105°, но это вызывается дополнительными причинами. Азот, элемент пятой группы таблицы, имеет следующее валентное окончание:
 .
.
Атом азота имеет три неспаренных электрона, которые участвовуют в образовании частиц, например, NH3.Три σ – связи, расположенные под углом 90° по отношению друг к другу, приводят к образованию молекулы, имеющей форму треугольной пирамиды с валентными углами 90° Углерод, элемент четвёртой группы таблицы, в возбуждённом состоянии имеет четыре неспаренных электрона и проявляет валентность, равную четырём
 .
.
Электроны, находящиеся в S- и в p-состояниях, не равноценны между собой, так как имеют разную конфигурацию и различный запас потенциальной энергии. Чтобы образовать равноценные связи, эти электроны должны гибридизироваться. Гибридизация электронов происходит по форме и энергии. S- и р – облака образуют гибридные – облака В атоме углерода происходит SP3 – гибридизация, которая приводит к образованию четырёх гибридных q – электронов: SP3  q4 .
q4 .
Четыре равноценных q – электрона образуют четыре равноценные σ – связи, например, в молекуле метана CH4. Такие молекулы (CH4, CCl4 и т.д.) имеют пространственную конфигурацию - тетраэдр с валентными углами 109°28'.
Бор, элемент третьей группы таблицы Менделеева, имеет вапентное окончание :
 .
.
В молекуле BCl3 все три связи должны быть образованы равноценными электродами, поэтому валентные электроны атома бора подвергаются гибридизации. В данном случае, SP2 -гибридизации, в результате которой образуются три гибридных q-электрона.
SP2  q3
q3
Молекула BCl3 имеет в пространстве конфигурацию плоского треугольника с валентными углами120°.
Элемент второй группы, бериллий, образует сложные частицы только в возбуждённом состоянии:
 .
.
Валентные электроны атома бериллия подвергаются Sp – гибридизации, в результате которой образуется два гибридных q – электрона.
SP  q2
q2
Два гибридных q – электрона, перекрываясь, образуют две σ – связи.
В результате образуется линейная молекула с валентным углом 180°.
Дата добавления: 2015-08-08; просмотров: 1110;
