Свойства атомов химических элементов.
2.1.Атомный радиус.Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности вешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
2.2.Признаком металличности элементов является их способность терять свои валентные электроны.
| Ме0 - е | 
| Ме+ | реакция окисления |
| восстановитель |
Мера металличности элементов является мерой их восстановительной способности. Металличность элементов имеет количественную характеристику - энергию ионизацииЕI, эВ/ат. Энергия ионизации – энергия, необходимая для отрыва электрона от атома.Чем ниже эта энергия, тем более активным металлом является данный элемент.Электрон самопроизвольно отрывается от атома в том случае, если Еj 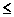 40 эВ/ат.
40 эВ/ат.
2.2.Признаком неметалличности элементов является способность принимать электроны, т.е. окислительная способность.
| Cl0 | + е | 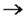
| Cl- реакция восстановления |

| окислитель |
Количественной характеристикой неметаличности элементов является сродство к электрону – F эВ/ат. Сродство к электрону – энергия, необходимая для отрыва принятого электрона. Чем выше сродство к электрону, тем более сильным окислителем, т.е. неметаллом, является данный элемент. Существует суммарная характеристика сродства к электрону и энергии ионизации. Это так называемая, относительная электроотрицательность элементов. Относительная электроотрицательность ЭО показывает способность атомов притягивать к себе электроны при связывании с другими атомами. Электроотрицательность измеряется в относительных величинах. Наиболее электроотрицательным из всех элементов является фтор (F) - его электроотрицательность в шкале Полинга принята равной 4,0. Остальные элементы по сравнению с фтором имеют меньшую электроотрицательность .

2.3. Характеристика кислородных соединений элементов. элементов.
Дата добавления: 2015-08-08; просмотров: 1149;
