Порядок заполнения атомных орбиталей.
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
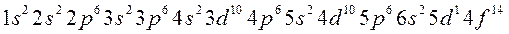
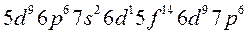 (2.3):
(2.3):
Пример 1. Напишите электронную формулу элемента Al и иона Al3+.Какие значения квантовых чисел n, l, m l, m s имеют валентные электроны атома 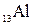 ?
?
Решение. 1. Электронную формулу атома алюминия составим согласно формуле (2.3):
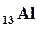
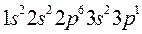 .
.
Ион Al3+имеет на три электрона меньше. чем нейтральный атом. При образовании иона в данном случае уходят электроны с внешнего третьего уровня. Таким образом, электронная формула иона алюминия будет выглядеть следующим образом: Al3+: 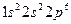 .
.
2. Известно, что валентными для s и p- элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1.
Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx:
а) n- главное квантовое число, определяется по номеру заполненного уровня;
б) l- побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня – l=1; для d-подуровня – l=2 и т.д.; х - число электронов на этом подуровне;
в) m l– магнитное квантовое число, принимающее следующие значения: 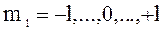 ;
;
г) m s-спиновое квантовое число, принимающее значения ±1/2.
Для определения квантовых чисел необходимо распределить валентные электроны по квантовым ячейкам: 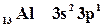
| 13 Al | 3s2 | 3p1 | |||||||
| ¯ | | ||||||||
| n= | 3 3 |
-1
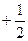
| |||||||
| l= | 0 0 | ||||||||
| ml = ms= | 0 0
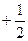 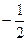
| ||||||||
8.Упражнения для самоконтроля направлены на закрепление следующих понятий:
Дата добавления: 2015-08-08; просмотров: 2742;
