Тема: Электролиз как окислительно-восстановительный процесс
Электролизом называют окислительно-восстановительный процесс, протекающий на электродах под действием постоянного электрического тока, подаваемого от внешнего источника, проходящего через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую.
Процесс электролиза производится в электролизере, куда заливают электролит и устанавливают два электрода. Электрод, на котором происходит реакция восстановления, называется катодом, подключается к отрицательному полюсу внешнего источника тока. Электрод, на котором происходит реакция окисления, называется анодом, подключается к положительному полюсу внешнего источника тока.
Схема электролиза

 е- е-
е- е-





 анод + – катод
анод + – катод

Электролиз водных растворов
Характер химических реакций в водных растворах на катоде определяется положением металла в ряду стандартных электродных потенциалов. Чем меньше значение электродного потенциала металла, тем труднее восстанавливаются его ионы на катоде. По этому признаку их разделяют на три группы.
К первой группе относятся катионы металлов, находящиеся в ряду напряжений левее алюминия. Они не восстанавливаются на катоде из водных растворов, вместо них происходит восстановление ионов водорода (молекул воды): 2Н++2е=Н2.
Ко второй группе относятся катионы металлов, расположенных в ряду напряжений между алюминием и водородом. Они восстанавливаются одновременно с водородом: Zn2++2е= Zn; 2Н++2е=Н2.
К третьей группе относятся катионы металлов, находящиеся в ряду напряжений после водорода. Они восстанавливаются на катоде: Cu2++2е= Cu.
Окисление на аноде имеет свои закономерности. Анионы бескислородных кислот и их солей (Cl-, Br-, J-, S2-, CN- и т.п.) удерживают свои электроны слабее молекул воды, поэтому при электролизе окисляются в первую очередь. В то же время анионы кислородсодержащих кислот (NO3-, SO42-, PO43- и т.п.) удерживают свои электроны прочнее, чем молекулы воды, поэтому на аноде происходит окисление гидроксил-анионов: 4ОН- – 4е = 2Н2О + О2.
Характер реакций, протекающих на аноде, зависит также от природы вещества анода. Различают растворимые и нерастворимые аноды. нерастворимые аноды изготавливают из углерода (графита), платины, а растворимые – из меди, цинка, никеля, железа, свинца и их сплавов. Нерастворимый анод сам не претерпевает изменений, а лишь является передатчиком электронов. При применении растворимого анода происходит не окисление анионов из раствора, а растворение металла, то есть переход ионов металла, из которого изготовлен анод, в раствор. Этот метод используется для получения чистых металлов (электрорафинирование), а также для получения покрытий (гальваностегия).
Рассмотрим несколько примеров электролиза с нерастворимым анодом водных растворов солей.
1. Раствор сульфата натрия Na2SO4, a(Na+)=1M, a(SO42-)=1M. В растворе имеются ионы Na+, SO42-, Н+, ОН-.
Na2SO4 ↔ 2 Na+ + SO42- ; Н2О ↔ Н+ + ОН-.
Так как φ0(Na+/ Na)=-2,7В<φ0(Н+/ Н2), то на катоде будет восстанавливаться водород, а на аноде – кислород: в растворе 2Н2О ↔ 2Н+ + 2ОН-. На катоде 2Н++2е=Н2. На аноде 2ОН- – 2е = Н2О + 1/2 О2. Суммарной является реакция разложения воды: Н2О=Н2+1/2О2.
2. Раствор хлорида натрия NaCl, a(Na+)=1M, a(Cl-)=1M. В растворе имеются ионы Na+, Cl-, Н+, ОН-. NaСl ↔ Na+ + Cl-; Н2О ↔ Н+ + ОН-.
На катоде пойдет восстановление водорода: 2Н++2е=Н2. На аноде идет окисление ионов хлора: 2Cl- - 2е = Cl2.
Электролиз расплавов
Рассмотрим электролиз расплавов на примере электролиза расплава хлорида натрия. В расплаве хлорида натрия имеются ионы натрия и хлора: NaСl ↔ Na+ + Cl-; если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
1) Катодный процесс – восстановление ионов натрия до металлического натрия (на отрицательном электроде) Na+ + е = Na+.
2) Анодный процесс – окисление ионов хлора на положительном электроде (с которого электроны идут во внешнюю цепь) 2Cl- - 2е = Cl2. Суммарная реакция 2NaCl = 2Na + Cl2.
Перенапряжение и поляризация
В процессе электролиза происходит изменение состава электродов с поверхности из-за образования на них продуктов электролиза. При этом образуется гальванический элемент, сила тока которого направлена обратно течению процесса электролиза. Это явление называется химической поляризацией. Для протекания электролиза необходимо приложить к электродам напряжение, большее, чем ЭДС образованного гальванического элемента. Наименьшая разность потенциалов, при которой протекает электролиз, называется потенциалом разложения Еразл.. Разность между потенциалом разложения и ЭДС гальванического элемента называется перенапряжением η.
Перенапряжение – это величина, которая показывает, насколько смещается электродный потенциал от равновесного значения.
Как катодное, так и анодное перенапряжение зависят от материала электродов, состояния их поверхности, от природы разряжающихся ионов и плотности тока.
Перенапряжение при электролизе может достигать значительной величины, что приводит к добавочному расходу электроэнергии. Поэтому стремятся создать такие условия, при которых величина η становится по возможности минимальной. Это достигается путем создания невысокой плотности тока.
Законы Фарадея
Электрохимические процессы на электродах подчиняются законам М. Фарадея.
1 закон Фарадея: массы веществ m, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества q, прошедшему через электролит: m=kq. Масса вещества, выделяющегося при прохождении одного кулона, называется электрохимическим эквивалентом k.
2 закон Фарадея: одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы веществ. Для выделения на электроде одного грамм-эквивалента любого вещества необходимо затратить одно и то же количества электричества, а именно 96500 Кл (называемого числом Фарадея).
Масса металла при электролизе на катоде, согласно законам Фарадея, может быть вычислена по формуле:
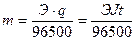 .
.
Здесь m – масса металла, г; Э – химический эквивалент металла, г/моль; t – продолжительность электролиза, с.
При электролизе во многих случаях выделяется веществ меньше, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления протекают побочные, параллельные процессы (в результате химической поляризации). Поэтому вводится понятие выхода по току χ, %. Оно представляет собой отношение массы полученного вещества в данных условиях электролиза mпр к массе, теоретически вычисленной на основании закона Фарадея mтеор:
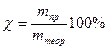
Применение электролиза
Электролиз широко используется в различных областях промышленности. Практически нет ни одной области техники, где бы он не применялся.
Электролиз в металлургии. Электролизом растворов солей получают медь, цинк, кадмий, никель, кобальт, марганец и другие металлы. На катоде происходит разряд ионов металла из раствора Mn+ + ne = M. В этих процессах используют нерастворимые аноды, на которых выделяется кислород: 2Н2О + 4е = О2 + 4Н+.
Метод электролиза используют для рафинирования металлов – меди, серебра, золота, свинца, олова и других. Анодом при рафинировании служит очищаемый металл. На аноде происходит растворение основного металла и примесей, потенциал которых отрицательнее потенциала основного металла. На катоде выделяется металл, имеющий более положительный потенциал. Так как потенциалы меди, серебра, свинца и олова положительнее, чем потенциалы других основных металлов ,то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе.
Электролиз в химической промышленности. К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора хлорида натрия с получением газообразных водорода и хлора на электродах и щелочи в электролизере. Кроме этого, электролизом получают фтор из расплава смеси плавиковой кислоты и фторида натрия, водород и кислород из воды, диоксид марганца из раствора сульфата марганца.
Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия для всех металлов и сплавов. Наиболее распространены никелирование, хромирование, меднение и цинкование.
Нанесение гальванических покрытий проводится в электролизере, называемом гальванической ванной. Катодом служит изделие, на которое наносится покрытие. На катоде идёт процесс восстановления находящихся в растворе электролита ионов металла Mn+ + ne = M. Анодом обычно служит тот же металл, что и металл-покрытие. Процесс на аноде противоположен процессу на катоде: M – ne = Mn+
Электрохимическая анодная обработка металлов и сплавов. Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов (ЭХОМ). Этот способ обработки металлов имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации. Как и при обычном электролизе с растворимыми анодами, при ЭХОМ происходит анодное растворение металла M – ne = Mn+. На катоде, который называют инструментом, обычно выделяется водород 2Н++2е=Н2. Особенностью ЭХОМ по сравнению с другими методами электролиза является высокая скорость растворения металлов. В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс-форм, твёрдых и тугоплавких металлов.
Дата добавления: 2015-08-08; просмотров: 1394;
