Тема: Электродные потенциалы и электродвижущие силы
Электрохимические процессы
Процессы прямого превращения химической энергии в электрическую и обратно называются электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (процессы в гальванических и топливных элементах); 2) процессы превращения электрической энергии в химическую (электролиз).
Электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическими проводниками. Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называются проводники, имеющие электронную проводимость (проводники первого рода), находящиеся в контакте с ионным проводником.
Понятие об электродном потенциале металла
При погружении металлической пластины в воду или раствор соли данного металла на границе металл – раствор возникает скачок потенциала. Появление такого скачка связано с особенностями строения кристаллической решетки металлов, в узлах которой находятся положительные ионы, заряд которых уравновешивается зарядом электронного газа. Положительно заряженные ионы в поверхностном слое металла под действием полярных молекул воды отрываются и в гидратированном состоянии переходят в раствор, который при этом заряжается положительно. В самом металле появляется избыток электронов, придающих ему отрицательный заряд. На границе металл – раствор образуется двойной электрический слой, а между металлом и окружающей его средой создается разность потенциалов, которая называется электродным потенциалом. Чем активнее металл, тем больше разность потенциалов между металлом и раствором, тем больше скачок потенциала.
 - + +
- + +
Металл - + + раствор
- + +
- + +
Двойной электрический слой на границе раздела металл – раствор
В двойном электрическом слое все время происходит движение ионов, причем одни из них входят обратно в кристаллическую решетку металла, другие снова переходят в раствор. Между раствором и поверхностью металла существует равновесие:
М+е– + nН2О ↔ М+ nН2О (в растворе) + е– (в металле).
Однако такое равновесие может быть смещено в ту или иную сторону.
Величина электродного потенциала зависит от ряда факторов, из которых основными являются природа металла (чем активнее металл, тем выше Е), природа растворителя (чем полярнее растворитель, тем больше Е) и концентрация ионов металла (повышение концентрации понижает Е).
Зависимость величины электродного потенциала от концентрации ионов металла и температуры выражается формулой Нернста:
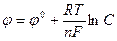
Здесь φ0 – нормальный (стандартный) электродный потенциал, возникающий на границе металл – раствор в том случае, когда металл помещен в раствор своей соли с концентрацией 1 моль/л, С – концентрация ионов металла, моль/л, R – универсальная газовая постоянная (8,314 Дж/моль˙град), Т – абсолютная температура, К, n – валентность иона, F – число Фарадея (96500 Кл/моль).
Подставляя в формулу Нернста величины R, F, значение Т = 298 К и переходя от натуральных логарифмов к десятичным, получаем сокращенную формулу Нернста: 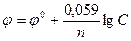 .
.
Она дает возможность рассчитать величину электродного потенциала при любой концентрации ионов металла в растворе при комнатной температуре.
Стандартный водородный электрод
В настоящее время за нулевое значение принят потенциал стандартного водородного электрода. Такой электрод состоит из платиновой пластины, контактирующей с газообразным водородом, находящимся под давлением 101 кПа, и раствором, в котором активность ионов водорода равна единице. Водородный электрод относится к газовым электродам. В качестве проводника первого рода для стандартного водородного электрода служит платина. При контакте платины с водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов водорода с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+ + 2е ↔ Н2
Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал стандартного водородного электрода, то есть потенциал при Р(Н2) = 1 атм (101 кПа) и аН+ = 1 моль/л.
Кроме водородного электрода, применяются и другие электроды сравнения.
Уравнение для расчета потенциала водородного электрода можно вывести также, как выведено уравнение для расчета потенциала металлического электрода. Для 298 К оно имеет вид
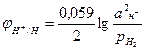
Где рН2 – парциальное давление водорода, аН+ - активность ионов водорода в электролите. Учитывая, что lgаН+=-рН, получим:
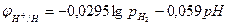
Потенциал водородного электрода принимает более отрицательное значение с увеличением давления водорода и рН.
Гальванические элементы. ЭДС гальванического элемента
Гальванический элемент состоит из двух электродов, в которых энергия химической реакции преобразуется в электрическую.
Примером может служить гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSO4, и цинковой пластины, погруженной в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn–2e↔Zn2+. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие: Cu–2e↔Cu2+. В результате возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение (φZn2+/Zn = -0,76 В) по сравнению с потенциалом медного электрода (φCu2+/Cu = 0,34 В). Цинковый электрод выполняет функцию анода, а медный – катода.
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) Реакция окисления цинка на аноде: Zn–2e↔Zn2+.
2) Реакция восстановления меди на катоде: Cu2++2e↔ Cu.
3) Движение электронов во внешней цепи;
4) Движение ионов в растворе: анионов SO42- к аноду, катионов (Zn2+, Cu2+) к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получим:
Cu2++ Zn↔ Cu+ Zn2+
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, то есть электрический ток, поэтому суммарная химическая реакция в гальваническом элементе называется токообразующей реакцией.
Схема работы гальванического элемента:
Анод (–) Zn / Zn2+ // Cu2+ / Cu (+) Катод
Границу раздела между проводником первого рода и проводником второго рода обозначают одной чертой, а границу раздела между проводниками второго рода – двумя чертами.
Максимальная разность потенциалов электродов называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента: ЭДС=φк – φа.
Например, для вычисления ЭДС медно-цинкового гальванического элемента надо от нормального электродного потенциала меди вычесть нормальный электродный потенциал цинка: ЭДС= φCu2+/Cu – φZn2+/Zn = 0,34-(-0,76) = 1,1 В. Чем больше отличаются металлы по величине своего электродного потенциала, то есть чем больше они отстоят друг от друга в ряду напряжений, тем больше ЭДС гальванического элемента, построенного из этих металлов. Движущей силой электрохимических процессов, протекающих в гальванических элементах, является изобарный потенциал (энергия Гиббса).
Связь между его изменением ΔG и ЭДС гальванического элемента Е выражают уравнением: ΔG= –nFE. Здесь n – число электронов, принимающих участие в окислительно-восстановительном процессе, F – число Фарадея. Чем больше ЭДС, тем больше отличается от нуля изменение изобарного потенциала ΔG.
Изменение потенциалов электродов при работе гальванических элементов называется гальванической поляризацией. Для её уменьшения применяют вещества, увеличивающие скорость катодных процессов. Такие вещества называют деполяризаторами. К ним относятся окислители (MnO2, O2, K2Cr2O7, Cu2+) и другие. Так, в медно-цинковом элементе деполяризатором служит раствор сульфата меди. Уменьшение поляризации гальванического элемента называют деполяризацией.
Концентрационные элементы
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным гальваническим элементом. Он состоит из двух одинаковых электродов, погруженных в растворы собственных солей разной концентрации, например: Cu / Cu2+ (а1) // Cu2+ (а2) / Cu, где а1<а2. Электрод, находящийся в более разбавленном растворе, является анодом. Он растворяется и его ионы переходят в раствор. На электроде, погруженном в более концентрированный раствор, осаждаются ионы металла – он является катодом. Таким образом, на обоих электродах идут процессы, приводящие к выравниванию концентраций ионов в растворах. Концентрационный элемент будет работать до тех пор, пока активности ионов в растворах у анода и катода не будут равны.
Дата добавления: 2015-08-08; просмотров: 1353;
