Примеры циклических систем, имеющих p,p-сопряжение
В молекуле бензола в p,p-сопряжении участвуют шесть р-орбиталей от шести атомов углерода, находящихся в sp2-гибридизации, на которых делокализуются шесть электронов. В молекуле нафталина в p,p-сопряжении участвуют десять р-орбиталей с десятью электронами.
р,p-Сопряжениевозникает, если в сопряжение с р-орбиталями, образующими p-связи, вступает р-орбиталь, не участвующая в образовании связей, причем эта р-орбиталь может быть вакантной или на ней могут находиться один или два электрона.
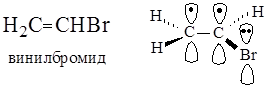
В молекуле винилбромида в р,p-сопряжении участвуют две р-орбитали атомов углерода, образующие p-связь, и р-орбиталь атома брома, не участвующая в образовании p-связи. Таким образом, в молекуле винилбромида на трех р-орбиталях делокализуются четыре электрона.
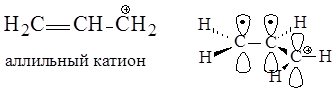
В аллильном катионе в р,p-сопряжении участвуют две р-орбитали атомов углерода, образующие p-связь, и вакантная р-орбиталь атома углерода, несущего положительный заряд. На трех р-орбиталях делокализуются два электрона и положительный заряд.
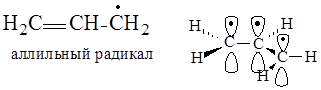
В аллильном радикале в создании сопряженной системы участвуют две р-орбитали, образующие p-связь, и р-орбиталь sp2-гибридизированного атома углерода, имеющая неспаренный электрон. На трех р-орбиталях делокализуются три электрона.
Как и p,p-сопряжение, р,p-сопряжение может иметь место в циклических системах.
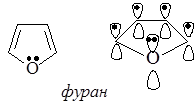
В молекуле фурана р-орбиталь атома кислорода, несущая неподеленную пару электронов, вступает в сопряжение внутри цикла с четырьмя р-орбиталями атомов углерода, образующими p–связи. В итоге возникает сопряженная система, в которой на пяти р-орбиталях делокализованы шесть электронов.

В молекуле фенола р-орбиталь атома кислорода, имеющая неподеленную пару электронов, вступает в р,p-сопряжение с р-орбиталью атома углерода, которая участвует в p,p-сопряжении внутри цикла. В этом случае возникает сопряженная система, в которой на семи р-орбиталях делокализованы восемь электронов.
Степень термодинамической устойчивости молекул характеризуется энергией сопряжения. Энергия сопряжения (энергия делокализации) – это та часть энергии, которую молекула теряет в результате сопряжения. Чем больше энергия сопряжения, тем стабильнее сопряженная система. Один из способов определения этой величины состоит в сравнении теплоты гидрирования бензола с ее расчетным значением, основанным на предположении о том, что бензол содержит три изолированные двойные связи:
| Теплота гидрирования циклогесена | -120 кДж/моль |
| Рассчитанная величина для бензола | 3× (-120) = -360 кДж/моль |
| Экспериментальная теплота гидрирования бензола | -209 кДж/моль |
| Энергия сопряжения бензола | -209 –(-360) = 151 кДж/моль |
Энергия сопряжения других ароматических соединений может быть определена таким же способом.
| Формула | Название соединения | Энергия сопряжения | Формула | Название соединения | Энергия сопряжения |
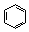
| Бензол | 151 | 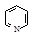
| Пиридин | 96 |
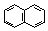
| Нафталин | 255 | 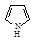
| Пиррол | 89 |
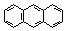
| Антрацен | 349 | 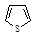
| Тиофен | 120 |
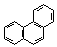
| Фенантрен | 382 | 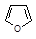
| Фуран | 66 |
В природе часто встречаются сопряженные системы. Чем длиннее сопряженная система, тем большее количество энергии выделяется при сопряжении, и в итоге получается более стабильная система.
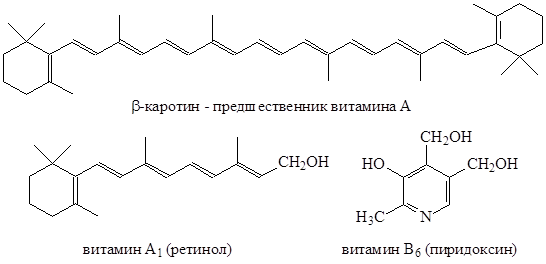
Примеры природных сопряженных систем
Ароматичность, критерии ароматичности
Среди циклических соединений с сопряженной системой двойных связей выделяют ароматические соединения, характеризующиеся повышенной термодинамической устойчивостью и особыми свойствами (низкая реакционная способность в реакциях присоединения, сравнительная легкость реакций замещения, сохраняющих сопряженную систему, устойчивость к окислению и другие). Соединение обладает ароматичностью, если:
- имеет плоский цикл, все атомы которого находятся в состоянии sp2-гибридизации;
- образуется сопряженная система p-электронов, охватывающая все атомы цикла;
- число электронов N(e), участвующих в сопряжении, удовлетворяет правилу Хюккеля: N(e) = 4n +2, гдеn = 0,1,2,3 и т.д.
Если не выполняется хотя бы один из этих критериев, то соединение не является ароматическим. Правило Хюккеля применимо к любым конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. Если число электронов N(e), участвующих в сопряжении, равно N(e) = 4n,такое соединение считается антиароматическим. Обычно такие соединения малоустойчивы.
Бензол является классическим представителем ароматических углеводородов, так как: имеет плоский цикл, все 6 атомов углерода находятся в состоянии sp2-гибридизации; образуется единая сопряженная система, охватывающая все атомы цикла (p,p-сопряжение); в сопряжении участвуют шесть электронов – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=6, n=1.
Нафталин, как и бензол, имеет плоский цикл, все 10 атомов углерода находятся в состоянии sp2-гибридизации, образуется сопряженная система, охватывающая все атомы цикла; в сопряжении участвуют 10 электронов (p,p-сопряжение) – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=10, n=2. Антрацен и фенантрен также удовлетворяют всем критериям ароматичности, в создании единой p,p-сопряженной системы в молекулах этих соединений участвуют 14 электронов.
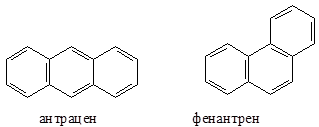
Эффект стабилизации присущ не только сопряженным шестичленным системам, но и трех-, четырех-, пяти-, семичленным системам, в которых число электронов, участвующих в сопряжении, удовлетворяет правилу Хюккеля. Такие соединения известны и подробно изучены. Они получили название небензоидных ароматических соединений.
Среди циклопропана и его производных ароматичным является только циклопропенил-катион, удовлетворяющий всем критериям ароматичности.
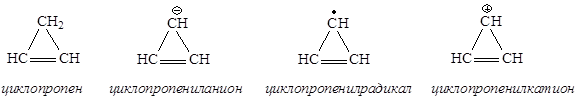
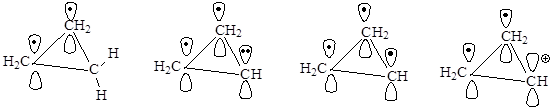
Циклопропен и его производные
Хотя все структуры являются плоскими, циклопропен относят к неароматическим соединениям (нет сопряженной системы), циклопропенил-радикал также является неароматическим соединением (в сопряжении 3 электрона), циклопропенил-анион относится к антиароматическим соединениям, так как в сопряжении участвуют 4 электрона. Циклопропенил-катион является ароматической системой, так как в результате сопряжения на трех атомах углерода делокализованы 2 электрона, т.е. N(e) = 4n+2=2, n = 0.
Циклобутадиен и циклооктатетраен являются антиароматическими соединениями, так как в сопряжении (p,p-сопряжение) участвуют, соответственно, 4 и 8 электронов, т.е N(e) = 4n, n=1; n=2). Циклопентадиен является неароматическим соединением, так как нет сопряженной системы, охватывающей все атомы цикла (один из атомов углерода в sp3-гибридизации).
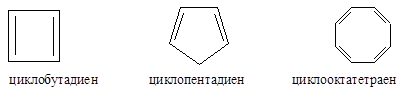
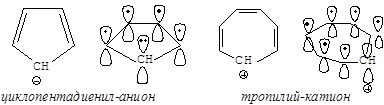
Но циклопентадиенил-анион и циклогептатриенил-катион – (катион тропилия) являются ароматическими системами, удовлетворяющими всем критериям ароматичности (все они имеют в сопряжении по 6 электронов).
Дата добавления: 2015-08-08; просмотров: 3112;
