Сопряженные системы, виды сопряжения
УДК
ББК
| ISBN 978-985-496-906-0 | © Павловский, Н.Д., 2011 © УО «ГрГМУ», 2011 |
 |
Лекция № 1
Предмет и задачи биоорганической химии. Взаимное влияние атомов и способы его передачи в органических молекулах. Сопряженные системы, ароматичность, электронные эффекты заместителей
Биоорганическая химия изучает связь между строением органических веществ и их биологическими функциями, используя методы органической и физической химии, а также физики и математики. Как самостоятельная наука, биоорганическая химия сформировалась во второй половине ХХ века на стыке биохимии и органической химии, на основе традиционной химии природных соединений. Объектами изучения являются биологически важные природные и синтетические соединения, главным образом биополимеры, а также витамины, гормоны, антибиотики, природные феромоны и сигнальные вещества, биологически активные вещества растительного происхождения, внутриклеточные регуляторы, а также синтетические регуляторы биологических процессов – лекарственные препараты, пестициды, инсектициды и другие соединения.
К основным задачам биоорганической химии относятся:
1. Разработка методов выделения и очистки природных соединений.
2. Определение строения и конфигурации изучаемого соединения.
3. Разработка методов синтеза как самих природных биологически важных веществ, так и их аналогов.
4. Изучение зависимости биологического действия от строения.
5. Выяснение химизма взаимодействия биологически активного вещества с живой клеткой или с ее компонентами.
Биоорганическая химия тесно связана с практическими задачами медицины и сельского хозяйства (получение витаминов, гормонов, антибиотиков, стимуляторов роста растений, регуляторов поведения насекомых и животных), химической, пищевой и микробиологической промышленности.
Сопряженные системы, виды сопряжения
Сопряженными системами называются соединения, в которых есть чередование двойных и ординарных связей. Простейшим примером такой системы является молекула бутадиена-1,3. Из структурной формулы видно, что в молекуле содержатся одна ординарная и две двойные связи углерод-углерод, которые должны иметь длины связей, соответственно, 0,153 нм и 0,132 нм, что характерно для длин ординарной и двойной связей углерод-углерод в алканах и алкенах. Физическими методами исследований было установлено, что длины связей между атомами С1 и С2, а также между С3 и С4 равны 0,135 нм, а длина связи между атомами С2 и С3 равна 0, 146 нм, молекула плоская, углы между связями равны 120°. Эти особенности объясняются возникновением сопряженной системы. Атомные орбитали всех атомов углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-гибридизации, в результате которой каждый из них имеет три гибридные орбитали, лежащие в одной плоскости под углом 120° и одну негибридную р-орбиталь, располагающуюся перпендикулярно этой плоскости.
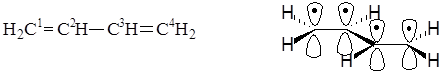
Пространственное строение бутадиена-1,3
Так как молекула имеет плоскую конфигурацию, то все s-связи, образованные с участием гибридных орбиталей, лежат в одной плоскости, а негибридные р-орбитали расположены перпендикулярно плоскости молекулы и параллельно между собой. Образование p-связей между атомами С1 и С2 и между атомами С3 и С4 происходит за счет двукратного перекрывания р-орбиталей с обеих сторон относительно плоскости молекулы, но так как все р-орбитали параллельны, то в молекуле имеет место дополнительное взаимодействие – перекрывание р-орбиталей между атомами С2 и С3, сопровождающееся выделением энергии, которая называется энергией сопряжения. В результате этого дополнительного перекрывания происходит перераспределение p-электронной плотности в молекуле и возникает делокализованная (сопряженная) p-система. При этом между атомами С1 и С2, а также С3 и С4 p-электронная плотность уменьшается, что приводит к увеличению длины этих связей в сравнении с длиной двойной связи С=С в алкенах, а между атомами С2 и С3 – p-электронная плотность увеличивается, что приводит к уменьшению длины связи в сравнении с длинами ординарных связей С-С в алканах.
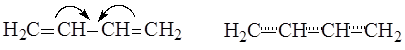
Делокализация p-электронной плотности в бутадиене-1,3
В реальной молекуле бутадиена-1,3 нет двойных или ординарных связей, все четыре р-электрона делокализованы по всей системе сопряжения, охватывающей углеродный скелет.
Таким образом, под термином сопряжение понимают делокализацию (перераспределение) p-электронной плотности в молекуле, приводящую к изменению длин связей и увеличению ее устойчивости за счет выделения энергии. Различают два типа сопряжения: p,p- и p,p-сопряжение, которые могут возникать как в циклических, так и ациклических молекулах.
p,p-Сопряжение возникает, если в сопряжении участвуют р-орбитали, образующие p-связи. В рассмотренной выше молекуле бутадиена-1,3 в сопряжении участвовали четыре электрона атомов углерода, расположенные на р-орбиталях, образующих p-связи, таким образом, можно сделать вывод о том, что в этом случае имеет место p,p-сопряжение.
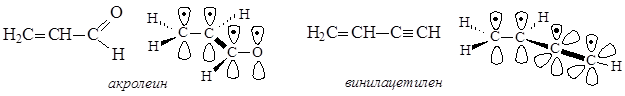
Примеры систем, имеющих p,p-сопряжение
В молекулах акролеина и винилацетилена сопряженная система возникает при участии четырех р-орбиталей, на которых находятся четыре электрона. В акролеине в p,p-сопряжении задействованы три р-орбитали атомов от трех атомов углерода, находящихся в sp2-гибридизации, и р-орбиталь атома кислорода. В винилацетилене в p,p-сопряжении участвуют две р-орбитали от двух атомов углерода, находящихся в sp2-гибридизации, и две р-орбитали от двух атомов углерода, находящихся в sp-гибридизации.
p,p-Сопряжение может быть и в циклических молекулах.
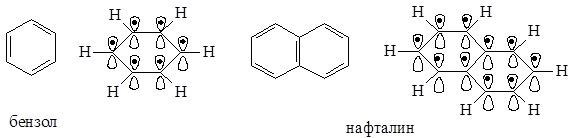
Дата добавления: 2015-08-08; просмотров: 4309;
