Стандартные электродные окислительно-восстановительные потенциалы.
Абсолютное значение электродного потенциала металлического электрода φMZ+/M определить невозможно. Нельзя присоединить прибор к двойному электрическому слою и измерить данную величину. Поэтому используют для измерения метод сравнения, в котором измеряемый потенциал, определяют посредством сравнения с известным потенциалом. Выбирают электрод сравнения, потенциал которого принимают равным нулю и относительно него измеряют потенциалы всех других электродов. При выборе электрода сравнения необходимо учитывать наличие у него стабильности и воспроизводимости характеристик в широком диапазоне температур.
Таким условиям отвечает стандартный водородный электрод (рис. 1), у которого активность ионов водорода в растворе равна 1 моль/л и давление газообразного водорода над раствором составляет 101,3 кПа. В качестве твердой фазы в водородном электроде используют инертный металл – платину.
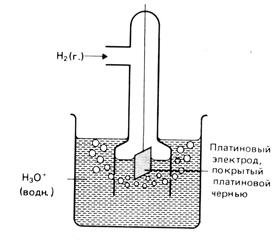
Рис. 1. Водородный электрод.
Конструктивно водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (которая представляет собой мелкозернистую платину), частично погруженной в раствор, содержащий ионы водорода. Такая платина инертна и обладает свойством адсорбировать водород. В качестве раствора используют нелетучие кислоты, обычно, такие как серная или хлорная кислоты. К пластинке подают газообразный водород под давлением 1 атм.
Сравнивая со стандартным водородным электродом, определяют стандартные потенциалы металлических электродов φ0MZ+/M . Полученные значения электродных потенциалов металлических электродов для разных веществ, выставляют в ряд (вертикальный или горизонтальный) в порядке возрастания значений. Таким образом, получают ряд стандартных электродных потенциалов или по-другому электрохимический ряд напряжений металлов.
Дата добавления: 2015-08-08; просмотров: 1508;
