Ионная теория электролиза.
Явление электролиза объясняет ионная теория электролиза. По этой теории прохождение постоянного электрического тока через электролит осуществляется с помощью ионов. При этом на электродах происходит перенос электронов к ионам, либо от них. На аноде осуществляется окислительная реакция. В этой реакции анионы теряют электроны и разряжаются, превращаясь в нейтральные частицы. Анод – это место стока электронов с анионов.
На катоде всегда осуществляется восстановительная реакция. Здесь электроны приобретают электроны. Катод выступает в роли источника электронов для катионов.
В качестве примера рассмотрим электролиз расплава бромида свинца (II). В данном случае на аноде происходит окисление, и разряжаются бромид-ионы в соответствии с реакцией
2Br-(ж) → Br2 (г) +2е-.
На катоде происходит процесс восстановления, и разряжаются ионы свинца
Pb2+ (ж) +2е- → Pb(т).
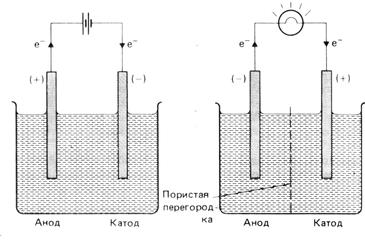
а б
Рис. 1. Различие электролиза (а) и гальванического элемента (б), обусловленные полярностью источника тока при электролизе.
Реакции, протекающие на аноде и катоде при электролизе, предопределяются полярностью источника тока во внешней электрической цепи (рис. 1а). Отрицательный полюс внешнего источника тока поставляет электроны одному из электродов. Это обуславливает отрицательный заряд данного электрода, он является катодом, так как здесь происходит электродная реакция, в которой осуществляется потребление электронов (восстановление).
На другом электроде электроны перетекают во внешнюю цепь из электролитической ячейки, что на рис. 1а показано стрелками. Это делает данный электрод положительным электродом, он играет роль анода и на нем происходит окисление (отдача электронов).
Дата добавления: 2015-08-08; просмотров: 1599;
