Способы выражения концентрации растворов
Многие химические реакции протекают в растворах. Растворы – это гомогенные (состоящие из одной фазы) многокомпонентные смеси переменного состава. Растворы могут быть газообразными, жидкими и твердыми. Среди соединений, образующих раствор, условно выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, который в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор, или компонент, содержание которого в растворе выше содержания остальных компонентов, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности водные, в которых растворителем является вода.
Для выражения состава раствора и содержания растворенного вещества применяют различные способы.
1. Массовая доля компонента ωi – отношение массы i-го компонента mi к массе раствора 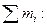
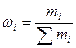 (11),
(11),
где ωi – безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100 % (в последнем случае говорят о процентной концентрации).
2. Молярная (мольная) доля компонента Xi – отношение числа молей i-го компонента ni к сумме молей  всех компонентов, образующих раствор, безразмерная величина
всех компонентов, образующих раствор, безразмерная величина
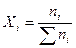 (12).
(12).
3. Моляльная концентрация, или моляльность, Сm – число молей n растворенного вещества, приходящихся на 1 кг растворителя, моль/кг:
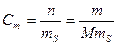 (13).
(13).
где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; mS –масса растворителя, кг.
4. Молярная концентрация, или молярность, С – число молей n растворенного вещества в 1 л раствора, моль/л, или сокращенно М:
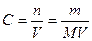 (14),
(14),
где V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
5. Молярная концентрация химического эквивалента, или нормальная концентрация, или нормальность, Сэкв – число молей химического эквивалента nэкв растворенного вещества в 1 л раствора, моль экв/л, или сокращенно н.:
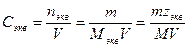 (15),
(15),
где Мэкв – молярная масса химического эквивалента растворенного вещества, г/моль экв; zэкв – число эквивалентности растворенного вещества; V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
6. Массовая концентрация, Смасс – масса растворенного вещества m в 1 л раствора, г/л:
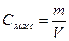 (16),
(16),
где V – объем раствора, л.
Можно применять и другие способы выражения состава раствора. Например, в справочниках растворимость данного вещества, т.е. состав насыщенного раствора, выражают как отношение массы растворенного вещества к массе растворителя.
При проведении химических реакций часто требуется использовать растворы определенной концентрации. Для приготовления раствора заданной концентрации взвешивают необходимую массу (отмеряют необходимый объем) чистых компонентов раствора. Также можно использовать более концентрированные растворы известной концентрации, в частности, фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения.
При расчете массы (объема) компонентов раствора учитывают соотношения между различными способами выражения его состава, например, представленные в таблице 1 соотношения концентраций бинарного раствора, то есть раствора, состоящего из двух компонентов – растворителя и растворенного вещества.
Таблица 1
Соотношения между различными способам выражения состава бинарного раствора
| Величина | ω | С | Сэкв | Сm | Cмасс |
| ω С Сэкв Сm Cмасс | —

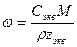
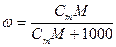
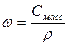
| 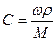 —
—
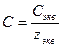
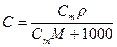
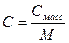
| 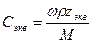
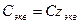 —
—
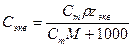
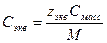
| 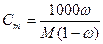
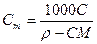
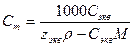 —
—
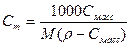
| 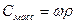
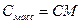
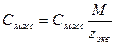
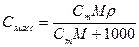 —
—
|
Примечание: ρ – плотность раствора данного состава, г/л.
Дата добавления: 2015-08-08; просмотров: 880;
