Типы растворов, термодинамика растворения
Растворы имеют важное практическое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи связаны с переводом питательных веществ в раствор. Растворами являются все физиологические жидкости, например, такие как кровь, лимфа. В основе многих производств лежат химические процессы, связанные с использование или производством растворов. Например, молочные продукты, творог, сметана, кефир, соки, напитки.
Молекулярным или истинным раствором называется гомогенная система, состоящая из двух и более компонентов. От молекулярных растворов следует отличать коллоидные растворы: суспензии, эмульсии, аэрозоли. Коллоидные от молекулярных растворов отличаются тем, что они представляют собой многокомпонентные гетерогенные системы. Примерами молекулярных растворов являются водный раствор хлористого натрия, воздух, сплав серебра с золотом. Уже из приведенных примеров видно, что типы растворов могут быть разные.
Растворы могут находиться в трех агрегатных состояниях: газообразном, жидком, твёрдом. Поэтому различают жидкие растворы, газовые растворы, твердые растворы. Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, который находится в том же агрегатном состоянии, что и сам раствор. Если все компоненты находятся в одинаковом состоянии, то растворителем считается тот компонент, который находится в большем количестве. Очень большое распространение имеют водные растворы, в которых растворителем является вода, например: водный раствор соляной кислоты, водный раствор спирта.
Жидкие растворы обладают элементами кристаллической структуры. В них имеется ближний порядок, то есть каждая частица раствора окружена определенным числом других частиц, находящихся от данной на строго определенном расстоянии. Для более удаленных частиц этот порядок нарушается. Растворы, как и все жидкости, не обладают дальним порядком, который наблюдается в кристаллах.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. Однородность раствора делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах растворах можно обнаружить многие свойства его отдельных компонентов, что не наблюдается у химических соединений. Непостоянство состава раствора приближает их к механическим смесям, но от последних они резко отличаются своей однородностью.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. В таких растворах при заданной температуре не может раствориться большее количество растворенного вещества. Насыщенный раствор находится в динамическом равновесии с нерастворимой частью растворяемого вещества. Например, если поместить в воду избыточное количество хлорида натрия, образуется насыщенный раствор, в котором твердый хлорид натрия находится в динамическом равновесии с растворенным хлоридом натрия
NaCl (тв.) 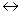 NaCl(водн.).
NaCl(водн.).
Большинство кристаллов растворяется в жидкостях с поглощением теплоты, однако при растворении таких веществ, как гидроксид натрия NaOH, карбонат калия K2CO3, сульфат меди CuSO4 происходит заметное увеличение температуры раствора. Выделяется теплота, но в меньших количествах, при растворении некоторых жидкостей и всех газов.
Количество теплоты, которое поглощается или выделяется при растворении одного моль вещества, называется теплотой растворения этого вещества. При растворении кристаллов происходит их разрушение, что требует затрат энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если наблюдается обратный эффект, то это говорит о том, что помимо растворения происходит взаимодействие между растворителем и растворенным веществом, в результате которого выделяется энергии больше, чем её расходуется на разрушение кристаллической решетки.
При растворении кристаллического вещества воде происходит сближение его частиц с дипольными молекулами воды, потенциальная энергия уменьшается, и теплота выделяется, то есть растворение сопровождается сжатием, которое рассматривается как уплотнение молекул растворителя вокруг каждой частицы растворяемого вещества. При этом частицы химически связываются с молекулами растворителя, образуя соединение, которое называется сольватом.
Совокупность молекул растворителя, окружающих частицу растворенного вещества, называется сольватной оболочкой. Взаимодействие молекул растворителя с частицами растворенного вещества называется сольватацией.
Если растворителем является вода, то сольватация называется гидратацией, а сольватную оболочку называют гидратной. Соединения молекул растворенного вещества с молекулами воды называются гидратами.
Гидраты, образующиеся в результате донорно-акцепорного взаимодействия, представляют собой частный случай комплексных соединений. Предположение о существовании в водных растворах гидратов было высказано и обосновано в 80-х годах 19 века Д.И. Менделеевым. Он считал, что растворение – это не только физический процесс, но и химический, что вещества, растворяющиеся в воде, образуют с ней соединения.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Дата добавления: 2015-08-08; просмотров: 1577;
