Восстановительных реакций
ЛЕКЦИЯ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными (ОВР) называ-ют реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ.
Основные понятия
· Степень окисления (с.о.) – условный заряд атома в химическом соединении. Степень окисления можно рассчитать, пользуясь следующими правилами:
· степень окисления атомов в простых веществах равна нулю ( 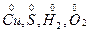 и др.);
и др.);
· степень окисления атомов водорода и щелочных металлов в большинстве сложных веществ равна +1 ( 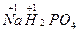 );
);
· степень окисления атомов кислорода в сложных веществах, как правило, равна -2 ( 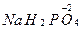 );
);
· алгебраическая сумма степеней окисления атомов в частице (молекуле или ионе) равна заряду этой частицы.
Например, подсчитать степени окисления атомов азота в соединении NH4NO3 можно, разделив эту соль на ионы, которые образуются при электролитической диссоциации солей: NH4+ и NO3-. Далее, для каждого иона составляем выражение суммы степеней окисления, включая неизвестную степень окисления атома азота х, и приравниваем его заряду иона.
Для иона NH4+:
х + 4 (+1) = +1, х = -3;
для иона NO3-:
х + 3 (-2) = -1, х = +5.
В формулах степень окисления при необходимости показывают арабской цифрой над символом элемента, например 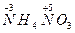 .
.
Большинство элементов способно проявлять несколько степеней окисления. Низшая степень окислениядля атомов металлов равна нулю, для атомов неметаллов – суммарному заряду электронов, необходимых для достройки последнего энергетического подуровня. Высшая степень окисленияато-мов элементов, как правило, равна номеру группы (исключе-ние – элементы VIII группы и побочной подгруппы I группы).
В частности, для азота известны соединения, в которых атом азота проявляет степени окисления от -3 - низшей до +5 - высшей:
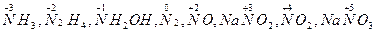 ,
,
степени окисления -2, -1, 0, +1, +2, +3, +4 называют промежуточными.
· Окисление и восстановление. Окислители и восста-новители.
Сущность этих понятий рассмотрим на примере окислительно-восстановительной реакции между цинком и раствором сульфата меди (II):
Zn + CuSO4 = ZnSO4 + Cu,
или в ионном виде
Zn0 + Cu2+ = Zn2+ + Cu0.
Атом цинка превращается в ион с зарядом +2, т.е. теря-ет два электрона (-2  ), а ион меди с зарядом +2 превращается в нейтральный атом, т.е. присоединяет два электрона (+2
), а ион меди с зарядом +2 превращается в нейтральный атом, т.е. присоединяет два электрона (+2  ); при этом степень окисления цинка повышается от 0 до +2, а меди понижается от +2 до 0.
); при этом степень окисления цинка повышается от 0 до +2, а меди понижается от +2 до 0.
· Вещество, отдающее электроны, называют восстанови-телем. Отдачу электронов атомами элемента и, следова-тельно, повышение степени окисления элемента называют окислением. Восстановитель в ходе реакции окисляется.
· Вещество, присоединяющее электроны, называют окисли-телем. Присоединение электронов атомами элемента и, следовательно, понижение степени окисления элемента называют восстановлением. Окислитель в ходе реакции восстанавливается.
В приведенном примере восстановитель – Zn0, окисляется до Zn2+ (ZnSO4), окислитель – Cu2+ (CuSO4), восстанавливается до Cu0.
По роли частиц в ОВР можно выделить три группы: только окислители; только восстановители; и окислители, и восстановители.
· Только окислители:
· из простых веществ – кислород и фтор;
· в составе сложных веществ - атомы в высшей степени окисления 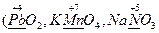 и др.
и др.  ;
;
· только восстановители:
· металлы в свободном состоянии;
· в составе сложных веществ - атомы в низшей степени окисления 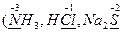 и др.
и др. 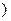 ;
;
· и окислители, и восстановители:
· неметаллы, кроме фтора и кислорода (S, As, С и др.);
· в составе сложных веществ - атомы в промежуточной степени окисления 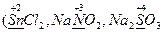 и др.
и др. 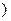 .
.
Составление уравнений окислительно-
восстановительных реакций
Существует несколько методов составления уравнений ОВР. Все методы основываются на уравнивании числа отданных и принятых электронов.
Для составления уравнений окислительно-восстанови-тельных реакций, протекающих в растворах электролитов, используют метод электронно-ионных полуреакций.
Дата добавления: 2015-08-08; просмотров: 744;
