Направление ОВР
В каждой окислительно-восстановительной реакции, в том числе, в реакции
Zn + CuSO4 = ZnSO4 + Cu, (1)
участвуют две окислительно-восстановительные пары
- восстановитель и его окисленная форма
Zn — Zn2+;
- окислитель и его восстановленная форма
Cu2+ — Cu.
Каждая пара имеет потенциальную возможность принимать и отдавать электроны. Мерой окислительно-восстановительной способности данной пары является окислительно-восстановительный или электродный потенциал,который обозначают 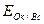 , где Ок-окисленная форма, Вс-восстановленная форма данной пары (например,
, где Ок-окисленная форма, Вс-восстановленная форма данной пары (например, 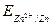 ,
, 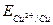 ). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар измерены или рассчитаны и приведе-ны в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2,
). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар измерены или рассчитаны и приведе-ны в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2, 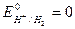 .
.
· Чем больше значение потенциала окислительно-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары. Чем меньше значение потенциала - тем более сильным восстановите-лем является восстановленная форма (Вс) окислительно-восстановительной пары. В частности, сильнейший окислитель – фтор, 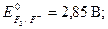 сильнейшие восстановители – щелочные металлы,
сильнейшие восстановители – щелочные металлы, 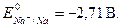
В ходе ОВР электроны всегда перемещаются от пары, содержащей восстановитель, к паре, содержащей окислитель. Обозначим
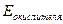 - о.-в. потенциал пары, содержащей окислитель;
- о.-в. потенциал пары, содержащей окислитель;
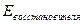 - о.-в. потенциал пары, содержащей восстано-
- о.-в. потенциал пары, содержащей восстано-
витель.
По значениям о.-в. потенциалов можно рассчитать ЭДС реакции: 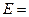
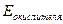 -
- 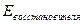 .
.
Условие самопроизвольного прохождения ОВР:
Дата добавления: 2015-08-08; просмотров: 1135;
