Метод электронно-ионных полуреакций
Составление уравнений ОВР данным методом рекомендуется выполнять в следующей последовательности:
· рассчитать степени окисления атомов элементов и по изменению степеней окисления определить окислитель и восстановитель;
· составить ионную схему реакции, выделить окислительно-восстановительные пары;
· составить электронно-ионные уравнения полуреакций окисления и восстановления, в которых уравнять число атомов элементов и заряд обеих частей полуреакций в определённой очерёдности:
· число атомов элементов, отличающихся от кислорода и водорода,
· число атомов кислорода,
· число атомов водорода,
· заряд обеих частей полуреакций;
· суммировать уравнения полуреакций с учётом дополнительных множителей, подобранных таким образом, чтобы уравнять число принятых и отданных электронов;
· в полученном ионном уравнении при необходимости выполнить алгебраические преобразования, и на его основе составить молекулярное уравнение.
Последовательность составления уравнений рассмотрим на конкретных примерах ОВР с заданными продуктами.
Пример 1.Реакция в кислой среде между перманганатом калия и нитритом натрия. Схема реакции:
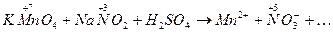
· Составляем ионную схему реакции, записав, как в ионных уравнениях, сильные растворимые электролиты в виде ионов, а остальные вещества виде молекул:
K+ + MnO4- + NO2 - + 2H+ + SO42- ® Mn2+ + NO3- + .
Рассчитываем степени окисления элементов, определяем окислитель и его восстановленную форму, восстановитель и его окисленную форму – окислительно-восстановитель-ные пары:
MnO4- ® Mn2+;
NO2- ® NO3-.
· Составляем уравнения полуреакций. Уравниваем в левой и правой частях каждой полуреакции число атомов всех элементов. Число атомов марганца и азота одинаково в обеих частях полуреакций. Уравнивание числа атомов кислорода и водорода выполняют с учётом среды, в которой происходит реакция. Если ОВР проходит в кислой среде, для уравнивания числа атомов кислорода и водорода в уравнения полуреакций можно включать только молекулы воды и ионы водорода:
MnO4- + 8H+ → Mn2+ + 4H2O
NO2- + H2O → NO3- + 2H+.
Таким образом, чтобы уравнять число атомов кислорода, а затем атомов водорода в кислой среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать n молекул воды, а в противоположную часть 2n ионов водорода.
· Уравниваем сумму зарядов ионов в левой и правой частях полуреакций, записывая в левую часть необходимое число электронов со знаками (+) или (–).
В первой полуреакции алгебраическая сумма зарядов ионов в левой части равна -1 + 8(+1) = +7, в правой равна +2, для уравнивания зарядов необходимо к левой части прибавить 5 электронов.
MnO4- + 8H+ + 5  = Mn2+ + 4H2O.
= Mn2+ + 4H2O.
В левой части второй полуреакции надо вычесть 2 элек-трона:
NO2- + H2O - 2  = NO3- + 2H+.
= NO3- + 2H+.
· Уравниваем число отданных и принятых электронов наименьшими множителями – коэффициентами и суммируем уравнения, умножив каждое слагаемое на соответствующий коэффициент:
 MnO4- + 8H+ + 5
MnO4- + 8H+ + 5  = Mn2+ + 4H2O 2
= Mn2+ + 4H2O 2
NO2- + H2O - 2  = NO3- + 2H+ 5
= NO3- + 2H+ 5
 |
2MnO4- + 5NO2- +16H+ +5H2O = 2Mn2+ + 5NO3- + 10H+ + 8H2O
· Приводим подобные члены в суммарном уравнении
2MnO4- + 5NO2- + 6H+ = 2Mn2+ + 5NO3- +3H2O,
и по полученному краткому ионному уравнению дописы-ваем молекулярное уравнение:
2KMnO4+ 5NaNO2+H2SO4 = 2MnSO4 + 5NaNO3 +3H2O + K2SO4.
· (Пояснить появление K2SO4 в продуктах реакции) Уравнение считается законченным, когда в продуктах реакции и исходных веществах содержится одинаковое число атомов каждого элемента.
Пример 2. Реакция между сульфатом марганца (II) и гипохлоритом калия в щелочной среде:
MnSO4 + KClO + NaOH ® MnO2 + Cl– + ….
Уравнение составляем в той же последовательности, которая приведена для реакций в кислой среде.
· Ионная схема реакции:
Mn2+ + SO42– + K+ + ClO– + Na+ + OH– ® MnO2 + Cl– +...
· Схемы полуреакций:
Mn2+ ® MnO2,
ClO– ® Cl–.
В исходных реагентах дана щелочь – NaOH, поэтому уравнения полуреакций составляем с учетом щелочной среды: число атомов кислорода и водорода уравниваем гидроксид-ионами ОН- и молекулами воды:
Mn2+ + 4OH– ® MnO2 + 2H2O,
ClO– + H2O ® Cl– + 2OH–.
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn2+ + 4OH– –2  = MnO2 + 2H2O,
= MnO2 + 2H2O,
ClO– + H2O + 2  = Cl– + 2OH–,
= Cl– + 2OH–,
т.е. первая полуреакция - окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn2+ + 4OH– –2  = MnO2 + 2H2O 1
= MnO2 + 2H2O 1
ClO– + H2O + 2  = Cl– + 2OH– 1
= Cl– + 2OH– 1
 |
Mn2+ + ClO– + 4OH– + H2O = MnO2 + Cl– + 2H2O + 2OH–
· Приводим подобные члены:
Mn2+ + ClO– + 2OH– = MnO2 + Cl– + H2O.
Молекулярное уравнение:
MnSO4 + KClO + 2NaOH = MnO2 + KCl + H2O + Na2SO4.
Пример 3.Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
KMnO4 + NaNO2 + H2O ® MnO2 + NO3– + ….
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
MnO4- + NO2- + H2O ® MnO2 + NO3– +….
· Схемы полуреакций:
MnO4- ® MnO2,
NO2- ® NO3–.
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н+ и ОН-, а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4- + 2H2O + 3  ® MnO2 + 4OH–
® MnO2 + 4OH–
NO2- + H2O – 2  ® NO3- + 2H+
® NO3- + 2H+
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:
 MnO4- + 2H2O + 3
MnO4- + 2H2O + 3  ® MnO2 + 4OH– 2
® MnO2 + 4OH– 2
NO2- + H2O – 2  ® NO3- + 2H+ 3
® NO3- + 2H+ 3
 |
2MnO4- +3NO2- + 4H2O + 3H2O = 2MnO2 + 3NO3– + 8OH- + 6H+
 |  |
7H2O 6H2O+2OH-
· После объединения ионов OH- и H+ в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
2MnO4- + 3NO2- + H2O = 2MnO2 + 3NO3– + 2OH-,
молекулярное уравнение:
2KMnO4 + 3NaNO2 + H2O = 2MnO2 + 3NaNO3 + 2KOH.
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем  - атом кислорода в составе сложной частицы):
- атом кислорода в составе сложной частицы):
кислая среда -  + 2Н+ = Н2О,
+ 2Н+ = Н2О,
Н2О =  + 2Н+;
+ 2Н+;
щелочная среда -  + Н2О = 2ОН-,
+ Н2О = 2ОН-,
2ОН- =  + Н2О;
+ Н2О;
нейтральная среда  + Н2О = 2ОН-,
+ Н2О = 2ОН-,
Н2О =  + 2Н+.
+ 2Н+.
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
Дата добавления: 2015-08-08; просмотров: 7446;
