Полимолекулярная сорбция
На практике часто встречаются изотермы, имеющие вид:

Рис. 7.6. Изотерма полимолекулярной сорбции.
Такой вид изотерм свидетельствует о том, что связывание адсорбтива адсорбентом не прекращается после образования мономолекулярного слоя, т.е. свидетельствует о полимолекулярной сорбции.
Теорию полимолекулярной адсорбции предложил Поляни (1915 г).
Исходные положения этой теории:
1. Адсорбция обусловлена чисто физическими силами.
2. На поверхности адсорбента нет активных центров. Адсорбционные силы действуют вблизи от поверхности и образуют около этой поверхности непрерывное силовое поле.
3. Адсорбционные силы действуют на сравнительно большие расстояния, благодаря чему образуется у поверхности адсорбента адсорбционный объем.
4. Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю.
5. Притяжение молекулы адсорбтива поверхностью не зависит от наличия в адсорбционном, пространстве других молекул.
6. Адсорбционные силы не зависят от температуры, т.е. с изменением температуры адсорбционный объем не изменяется.
Силовое поле у поверхности по этой теории сравнивают с гравитационным полем.


Рис. 7.7. Схема адсорбционного объема.
В зависимости от условий адсорбции и природы адсорбента и адсорбтива применима теория Ленгмюра или Поляни. Обобщенная теория была развита Брунауэром, Эмметом и Теллером (1935-1940 г.). Их теория получила название БЭТ.
Основные положения теории БЭТ:
1. На поверхности адсорбента имеется определенное количество равноценных в энергетическом отношении центров, способных удерживать молекулы адсорбтива.
2. Допускается, что взаимодействие между соседними адсорбированными молекулами отсутствует.
3. Каждая молекула первого слоя является активным центром для адсорбции и образования второго адсорбционного слоя, и т.д.
4. Предполагается, что все молекулы во втором и более далеких слоях имеют такую же сумму статических состояний как в жидком состоянии, которое отличается от суммы состояний первого слоя.
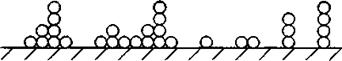
Рис. 7.8. Схема полимолекулярной адсорбции,
принятая по теории БЭТ.
На основе этих представлений Брунауэр, Эммет и Теллер предложили уравнение изотермы адсорбции паров:
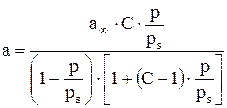
где 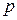 - давление пара;
- давление пара;
 - давление насыщенного пара при данной температуре;
- давление насыщенного пара при данной температуре;
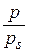 - относительное давление пара;
- относительное давление пара;
С - константа равновесия полимолекулярной сорбции.
При 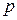 далеких от
далеких от  и С>>1, адсорбция мономолекулярная и уравнение БЭТ переходит в уравнение Лэнгмюра.
и С>>1, адсорбция мономолекулярная и уравнение БЭТ переходит в уравнение Лэнгмюра.
По мере приближения 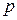 к
к  число свободных активных центров сокращается. При
число свободных активных центров сокращается. При 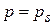 происходит объемная конденсация пара.
происходит объемная конденсация пара.
Уравнение БЭТ легко приводится к линейной форме:
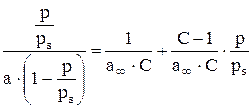
По наклону прямой и отсекаемому на оси ординат отрезку находят 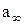 и
и 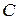 . Найдя
. Найдя 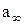 можно вычислить удельную поверхность адсорбента
можно вычислить удельную поверхность адсорбента 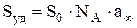 , где
, где 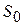 - площадь, занимаемая одной молекулой;
- площадь, занимаемая одной молекулой; 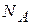 - число Авогадро.
- число Авогадро.
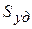 найденное с помощью теории БЭТ, совпадают со значениями, полученными неадсорбционными методами, что свидетельствует о правильности теории БЭТ.
найденное с помощью теории БЭТ, совпадают со значениями, полученными неадсорбционными методами, что свидетельствует о правильности теории БЭТ.
Дата добавления: 2015-08-08; просмотров: 1252;
