АБСОРБЦИЯ
Тема 3.3. Абсорбция 12ч., в т.ч. лаб. раб. и практ. занят 6ч.
Студент должен:
знать:
- физические основы и теорию процесса абсорбции (равновесие между фазами, принципы составления материального теплового баланса, уравнение рабочей линии);
- порядок расчета насадочного и барботажного абсорбера;
- сущность и методы проведения десорбции;
уметь:
- составлять материальный и тепловой баланс;
- определять расход поглотителя;
- строить равновесную и рабочую линию процесса;
- определять основные габаритные размеры абсорберов, пользуясь справочниками.
Назначение абсорбции. Абсорбция при разделении гомогенных газовых смесей и очистки газов. Выбор абсорбента. Физическая абсорбция и абсорбция, сопровождаемая химическим взаимодействием. Десорбция.
Равновесие между фазами при абсорбции. Влияние температуры и давления на растворимость газов в жидкостях. Материальный баланс процесса и уравнения рабочей линии при абсорбции и десорбции. Расход абсорбента. Тепловой баланс абсорбции. Отвод тепла при абсорбции.
Абсорбцией называют процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидкими поглотителями – абсорбентами.
Принцип абсорбции основывается на различной растворимости компонентов газовых и парогазовых смесей в жидкостях при одних и тех же условиях. Поэтому выбор абсорбентов осуществляют в зависимости от растворимости в них поглощаемых компонентов, которая определяется:
· физическими и химическими свойствами газовой и жидкой фаз;
· температурой и давлением осуществления процесса;
· содержанием газа в смеси.
При выборе абсорбента необходимо учитывать такие его свойства, как селективность (избирательность) по отношению к поглощаемому компоненту, токсичность, пожароопасность, стоимость, доступность и др.
Различают физическую абсорбцию и химическую абсорбцию (хемосорбцию). При физической абсорбции поглощаемый компонент образует с абсорбентом только физические связи. Процесс этот в большинстве случаев является обратимым. На этом свойстве основано выделение поглощенного компонента из раствора – десорбция. Если поглощаемый компонент вступает в реакцию с абсорбентом и образует химическое соединение, то процесс называют хемосорбцией.
Процесс абсорбции обычно является экзотермическим, т. е. сопровождается выделением теплоты.
Абсорбция широко используется в промышленности для разделения углеводородных газов на нефтеперерабатывающих установках, получения соляной и серной кислот, аммиачной воды, очистки газовых выбросов от вредных примесей, выделения ценных компонентов из газов крекинга или пиролиза метана, из газов коксовых печей и т. д.
Равновесие в процессах абсорбции определяется правилом фаз Гиббса (В.4), представляющим обобщение условий гетерогенного равновесия:
C = К - Ф + 2.
Поскольку процесс абсорбции осуществляется в двухфазной (газ – жидкость) и трехкомпонентной (один распределяемый и два распределяющих компонента) системе, число степеней свободы – три.
Таким образом, равновесие в системе газ (пар) – жидкость может характеризоваться тремя параметрами, например температурой, давлением и составом одной из фаз.
Равновесие в системе газ – жидкость определяется законом растворимости Генри, согласно которому при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:

где р – парциальное давление газа над раствором; х – мольная концентрация газа в растворе; Е – коэффициент пропорциональности (коэффициент Генри).
Закон Генри распространяется в первую очередь на слаборастворимые газы, а также на растворы с низкими концентрациями хорошо растворимых газов при отсутствии химической реакции.
Коэффициент Е имеет размерность давления, совпадающую с размерностью р, и зависит от природы растворяющегося вещества и температуры. Установлено, что с увеличением температуры растворимость газа в жидкости уменьшается. Когда в равновесии с жидкостью находится смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Поскольку тепловой эффект, сопровождающий процесс абсорбции, отрицательно сказывается на положении линии равновесия, он должен обязательно учитываться при расчетах. Количество теплоты, выделяющейся при абсорбции, может быть определено по зависимости
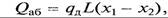
где qд - дифференциальная теплота растворения в пределах изменения концентрации х1 – х2; L – количество абсорбента.
Если абсорбция ведется без отвода теплоты, то можно допустить, что вся выделяющаяся теплота идет на нагревание жидкости, и температура последней повышается на величину
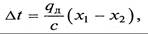
где с – теплоемкость раствора.
Для понижения температуры исходную газовую смесь и абсорбент охлаждают, отводя теплоту, выделяющуюся в процессе абсорбции, с помощью встроенных (внутренних) или наружных теплообменников.
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть определено по закону Дальтона, согласно которому парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т. е.

где Р – общее давление газовой смеси; у – мольная концентрация распределяемого в смеси газа.
Сопоставляя уравнения (10.2) и (10.1), найдем
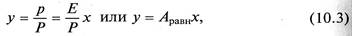
где Аравн = Е/Р – константа фазового равновесия, применимая для областей действия законов Генри и Дальтона.
Пусть Раб – давление паров чистого абсорбента в условиях абсорбции; раб – парциальное давление паров абсорбента в растворе; Р – общее давление; х – мольная доля абсорбируемого газа в растворе; у – мольная доля распределяемого газа в газовой фазе; уаб – мольная доля абсорбента в газовой фазе.
Согласно закону Рауля парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе:

По закону Дальтона (10.2) парциальное давление абсорбента в газовой фазе равно

При равновесии
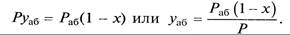
Анализ факторов, влияющих на равновесие в системах газ (пар) – жидкость, позволил установить, что к параметрам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, - пониженное давление, повышенная температура и введение в абсорбент добавок, уменьшающих растворимость газов в жидкостях.
Материальный баланс процесса абсорбции выражается дифференциальным уравнением
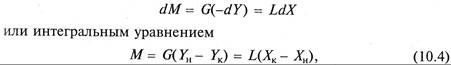
где G – поток газовой смеси (инертного газа), кмоль/с; L – поток абсорбента, кмоль/с; Yн и Yк – начальное и конечное содержание распределяемого вещества в газовой фазе, кмоль/кмоль инертного газа; Хк и Хн – начальное и конечное содержание распределяемого вещества в абсорбенте, кмоль/кмоль абсорбента; М – количество распределяемого вещества, перенесенного из фазы G в фазу L в единицу времени, кмоль/с.
Из уравнения материального баланса (10.9) можно определить необходимый общий расход абсорбента

Процесс абсорбции характеризуется также степенью извлечения (поглощения), представляющей отношение количества фактически поглощенного компонента к количеству, поглощаемому при полном его извлечении,
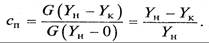
Кинетика процесса абсорбции характеризуется тремя основными стадиями, которые соответствуют схеме, представленной на рис. 9.4.
Первая стадия – перенос молекул абсорбируемого компонента из ядра потока газа (пара) к поверхности раздела фаз (поверхности жидкости).
Вторая стадия – диффундирование молекул абсорбируемого компонента через поверхностный слой жидкости (граница раздела фаз).
Третья стадия – переход молекул абсорбируемого вещества от поверхности раздела фаз в основную массу жидкости.
Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для двухфазных систем:
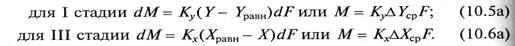
Экспериментально установлено, что вторая стадия процесса абсорбции идет с большей скоростью и не влияет на общую скорость процесса, ограниченную скоростью наиболее медленной стадии (первой или третьей).
Движущая сила процесса абсорбции для I и III стадий в уравнениях (10.5а) и (10.6а) может быть выражена через другие параметры:
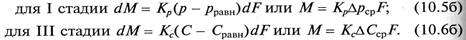
В уравнениях (10.5б) и (10.6б) р – рабочее парциальное давление распределяемого газа в газовой смеси; рравн – равновесное давление газа над абсорбентом, соответствующее рабочей концентрации в жидкости; С – рабочая объемная мольная концентрация распределяемого газа в жидкости; Сравн – равновесная объемная мольная концентрация распределяемого газа в жидкости, соответствующая рабочему парциальному давлению его в газовой смеси.
При таком выражении движущей силы процесса абсорбции уравнение равновесной зависимости принимает вид
С = Ψр,
где Ψ – коэффициент пропорциональности, кмоль/(м3*Па).
Коэффициенты массопередачи выражаются для уравнений (10.5а) и (10.6а) в виде
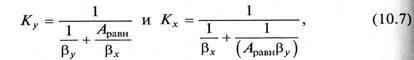
для уравнений (10.5б) и (10.6б)
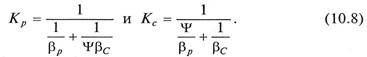
В уравнениях (10.7) и (10.8) βу, βр – коэффициенты массоотдачи от потока газа к поверхности контакта фаз; βх, βС - коэффициенты массоотдачи от поверхности контакта фаз к потоку жидкости.
Коэффициенты массоотдачи по газу и жидкости βу и βх могут быть определены из критериальных уравнений, имеющих вид:
для газовой фазы Nuдиф у = f*(Re, Prдиф у);
для жидкой фазы Nuдиф х = f*(Re, Prдиф х).
Величина коэффициента Ψ оказывает существенное влияние на кинетику процесса абсорбции. Если Ψ имеет высокие значения (высокая растворимость компонента – диффузионное сопротивление сосредоточено в газовой фазе), то 1/(βc*Ψ) < 1/βр или КР ≈ βр. Если Ψ мало (извлекаемый компонент трудно растворим – диффузионное сопротивление сосредоточено в жидкой фазе), то Ψ/βр << 1/βс и можно считать Кс ≈ βс
Так же, как для массоо6менных процессов при L/G = const, рабочие линии процесса абсорбции являются прямыми и описываются в случае противотока уравнением (9.4), а прямотока – уравнением (9.5).
Средняя движущая сила в уравнениях (10.5а) и (10.6а) определяется в случае прямолинейной равновесной зависимости через относительные мольные концентрации компонентов по зависимостям (9.6) и (9.7).
Эти же зависимости можно использовать и при выражении движущей силы процесса абсорбции через парциальные давления распределяемого компонента в газе или объемные мольные концентрации этого же компонента в жидкости в уравнениях (10.5б) и (10.6б)
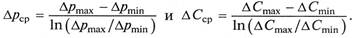
Здесь Δрmax, Δрmin – большее и меньшее значения движущей силы в начале и конце процесса абсорбции, выраженные через разность парциальных давлений поглощаемого компонента; ΔСmax, ΔСmin – большее и меньшее значения движущей силы в начале и конце процесса абсорбции, выраженные через объемные мольные концентрации поглощаемого компонента в жидкости.
В случае Δpmax/Δpmin ≤ 2, ΔCmax/ΔCmin ≤ 2 при сохранении линейности равновесной зависимости средняя движущая сила процесса абсорбции может равняться среднеарифметическому этих значений.
При проведении процесса абсорбции, сопровождаемой химической реакцией (хемосорбция), протекающей в жидкой фазе, часть распределяемого компонента переходит в химически связанное состояние. В результате этого концентрация растворенного (физически связанного) распределяемого компонента в жидкости уменьшается, что приводит к увеличению движущей силы процесса по сравнению с чисто физической абсорбцией.
Скорость хемосорбции зависит как от скорости массопередачи, так и от скорости химической реакции. В этом случае различают диффузионную и кинетическую области протекания хемосорбции. В диффузионной области скорость процесса определяется скоростью массопередачи, в кинетической – скоростью химической реакции. В тех случаях, когда скорости массопередачи и реакции соизмеримы, процессы хемосорбции протекают в смешанной, или диффузионно-кинетической, области.
При расчете хемосорбции коэффициент массоотдачи в жидкой фазе, учитывающий протекающую в ней химическую реакцию β′х, может быть выражен через коэффициент массоотдачи при физической абсорбции βх с учетом фактора ускорения массообмена Фм, показывающего, во сколько раз увеличится скорость абсорбции за счет протекания химической реакции:
β′х = βх* Фм
Фактор Фм определяют по графическим зависимостям.
Дата добавления: 2015-08-14; просмотров: 8802;
