Адсорбция на границе раствор-газ
Выше были рассмотрены представления о поверхностном натяжении индивидуальных жидкостей. На поверхностное натяжение растворов сильное влияние оказывает адсорбция.
Количественно соотношение между адсорбцией растворимого вещества (в кмоль на 1 м2 поверхности) и изменением поверхностного натяжения (s) с концентрацией раствора С (кмоль/м3) определяется уравнением Гиббса:
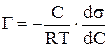
Из уравнения следует, что при 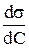 <О Г > 0, т.е. происходит накопление вещества в поверхностном слое; при
<О Г > 0, т.е. происходит накопление вещества в поверхностном слое; при 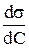 >О Г< 0 - уменьшение концентрации вещества в поверхностном слое (
>О Г< 0 - уменьшение концентрации вещества в поверхностном слое ( 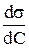 - поверхностная активность).
- поверхностная активность).
Все растворимые вещества по их способности адсорбироваться на границе жидкость-воздух можно разделить на две группы:
- поверхностно-активные вещества ( Г >0 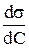 <0 );
<0 );
- поверхностно-неактивные вещества ( Г <0 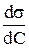 >0 ).
>0 ).
Поверхностно-активные вещества способны накапливаться в поверхностном слое. Они должны обладать поверхностным натяжением меньшим поверхностного натяжения растворителя (иначе накопление вещества на поверхности термодинамически невыгодно) и сравнительно малой растворимостью (иначе они бы стремились уйти с поверхности в глубь раствора).

Рис. 7.9. Зависимость поверхностного натяжения от
концентрации раствора:
1 - для поверхностно-активного вещества;
2 - для поверхностно-неактивного вещества;
3 - вещества не влияющие на поверхностное натяжение растворителя.
Характерной особенностью строения ПАВ является их дифильность, т.е. молекула состоит из двух частей — полярной группы и неполярного углеводородного радикала. Обладающая значительным дипольным моментом и хорошо гидратирующаяся полярная группа (ОН, СООН, RН2) обусловливает сродство ПАВ к воде. Гидрофобный углеводородный радикал является причиной неполной растворимости этих соединений.

ПАВ относительно воды: жирные кислоты, соли жирных кислот, сульфокислоты и их соли, спирты, амины.

Рис. 7.10. Расположение молекул в поверхностном слое:
а - высокая концентрация ПАВ;
б - малая концентрация ПАВ.
Поверхностная активность и адсорбируемость зависят от природы полярной группы, строения молекулы и длины радикала ( СН3СООН -уксусная кислота растворима; С5Н11СООН - капроновая кислота - не растворима).
Правило Дюкло-Траубе: в любом гомологическом ряду, при малых концентрациях, удлинение углеводородной цепи на СН2 группу, увеличивает поверхностную активность в 3-3,5 раз.
Правило Дюкло-Траубе справедливо при свободном расположении адсорбированных молекул в поверхностном слое параллельно поверхности (рис. 7.10б).
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации выражается эмпирическим уравнением Шишковского:
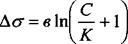
где в и К - эмпирические постоянные, причем в постоянная для всего гомологического ряда, а К - увеличивается в 3-3,5 раза для каждого последующего члена, в соответствии с правилом Дюкло-Траубе.
Дата добавления: 2015-08-08; просмотров: 2346;
