Лекция 7.Поверхностные явления. Адсорбция
Основные определения.
Изотерма адсорбции. Причины адсорбции.
Теории адсорбции.
Частные случаи адсорбции.
Одним из основных поверхностных явлений в коллоидных системах, обладающих поверхностью, является адсорбция. С адсорбцией связаны коагуляция, пептизация, изменение знака заряда частиц и другие явления.
Адсорбцией называется концентрирование газообразного или растворенного вещества на поверхности раздела фаз.
Различают понятия: сорбция, адсорбция, абсорбция.
Сорбция - поглощение каким-либо веществом других веществ.
Адсорбция - протекание процесса сорбции только на поверхности, увеличивается концентрация вещества на границе раздела фаз.
Абсорбция - поглощение вещества всем объемом другого вещества. При абсорбции поглощаемое вещество диффундирует вглубь абсорбента
Вещество, на поверхности которого идет адсорбция, называется адсорбентом, т.е. адсорбент - это вещество, адсорбирующее другое вещество.
Вещество, которое адсорбируется, называется адсорбтивом или адсорбатом.
Адсорбция Г выражается количеством адсорбтива (адсорбата) в молях, адсорбировавшегося на поверхности адсорбента, площадью 1 м2: 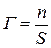 (моль/м2) или
(моль/м2) или 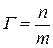 (моль/кг) - если площадь трудно рассчитать.
(моль/кг) - если площадь трудно рассчитать.
Для определения адсорбции необходимо найти экспериментально давление газа или количество адсорбтива в объеме, в котором происходит адсорбция, до и после адсорбции. Чаще всего адсорбцию определяют по привесу адсорбента.
Общую термодинамическую теорию адсорбции разработал в конце XIX века Гиббс. В XX веке адсорбцию исследовали: Лэнгмюр, Поляни, Брунауэр, Гурович, Шилов, Дубинин и др.
Различают адсорбцию физическую и химическую.
Физическая адсорбция обеспечивается силами Ван-дер-Ваальса, протекает самопроизвольно, молекулы адсорбтива могут перемещаться по поверхности (нелокализованная адсорбция), характеризуется обратимостью, отсутствием стехиометрических соотношений, уменьшением адсорбции при повышении температуры, сопровождается десорбцией. Процессы адсорбции и десорбции находятся в равновесии: адсорбция « десорбция.
Химическая адсорбция или хемосорбция обусловлена химическим взаимодействием адсорбента с адсорбтивом. Молекулы адсорбтива не могут перемещаться по поверхности адсорбента. Необратима. Тепловой эффект близок к энергии образования химических соединений. Повышение температуры способствует хемосорбции.
Адсорбцию чаще всего характеризуют зависимостью количества адсорбируемого вещества а от концентрации или давления 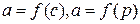 при Т = соnst. Эти зависимости называются изотермами адсорбции.
при Т = соnst. Эти зависимости называются изотермами адсорбции.
На изотерме можно выделить три участка:
1-й - адсорбция пропорциональна концентрации вещества;
3-й участок - поверхность насыщена адсорбтивом;
2-й участок - промежуточное состояние.
Изотерма адсорбции по виду напоминает параболу.
|  |
Рис. 7.1. Изотермы адсорбции.
Для аналитического выражения изотермы, Фрейндлих предложил эмпирическое уравнение вида:
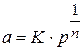
где 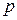 - равновесное давление газа в системе;
- равновесное давление газа в системе;
К и п - константы.
Для сорбции твердого вещества из раствора:
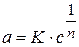
где с - равновесная концентрация;
п находится в пределах 0,1 - 0,5 и характеризует степень приближения изотермы к прямой.
Физический смысл константы К становится ясным, если принять с=1. Тогда К представляет собой величину адсорбции при равновесной концентрации адсорбтива, равной 1 моль/л.
Адсорбция обусловлена разными причинами.
Физическая сорбция осуществляется за счет сил Ван-дер-Ваальса между электронейтральными молекулами (1-10 кДж/моль).
Различают полярные и неполярные силы Ван-дер-Ваальса, проявление которых зависит от полярности молекул. Полярные силы делят на электростатические и индукционные.
К электростатическим относят силы, возникающие между молекулами, имеющими постоянный дипольный момент.
Индукционные силы также имеют электростатическую природу, но возникают между молекулой, имеющей постоянный дипольный момент, и неполярной молекулой, в которой индуцируется дипольный момент под действием первой полярной молекулы.
Неполярные (дисперсионные) силы возникают между неполярными молекулами и имеют сложную квантовомеханическую природу. Происхождение этих сил следующее: в неполярной молекуле можно выделить один электрон и рассмотреть его движение относительно ядер. Вследствие того, что электрон движется на некотором расстоянии от ядер, в молекуле в каждый момент времени возникает диполь, индуцирующий диполь в соседней молекуле.
Все виды Ван-дер-Ваальсового взаимодействия убывают пропорционально расстоянию между молекулами в шестой степени, т.е. для них характерен закон " 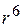 ".
".
Чаще всего возникают все виды Ван-дер-Ваальсового взаимодействия одновременно, но с разной долей участия каждого вида. Вклад каждого из взаимодействий оценить сложно. Но качественно можно оценить виды сорбционного взаимодействия, зная строение адсорбента и адсорбтива.
Причиной адсорбции, близкой к физической, может быть также образование водородной связи. Атом водорода имеет значительно меньшие размеры, чем другие атомы и поэтому его ядро может подходить особенно близко к неподеленным парам электронов других атомов.
С этим связаны два важных свойства атома водорода.
Первое свойство заключается в большой подвижности водорода связанного с электроотрицательными атомами, имеющими неподеленную пару электронов (группа азота, кислорода, фтора). Связанный с этими атомами водород очень мало экранирован и к нему близко может подойти другой электроотрицательный атом, имеющий активную неподеленную пару электронов. Энергия электростатического притяжения между ними оказывается соизмеримой с энергией прежней связи.
Второе свойство заключается в том, что при сближении двух молекул до расстояния, допускающего переход протона, последний притягивается к обеим атомам и удерживает один ковалентной, а другой водородной связью, причем, между ними может происходить перемещение по схеме:
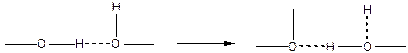
Вследствие этого, водородную связь рассматривают как донорно-акцепторную или как промежуточный тип связи между химической и физической связями.
Водородная связь невелика — 2-10 ккал/моль, но играет эта связь чрезвычайно важную роль, так как суммарно может равняться химической. Например, в полиуретанах, где суммарно величина водородных связей может составлять 100 -200 ккал/моль.
Водородную связь обеспечивают группы:
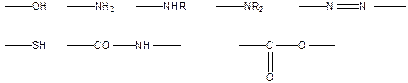
В качестве донора электронов может выступать p-электронное облако двойных алифатических связей >С=С< или ароматической системы:
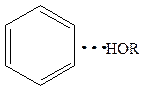
Вода удерживается на поверхностях за счет водородной связи.
Гидроксилированная поверхность силикагеля удерживает воду по схеме:
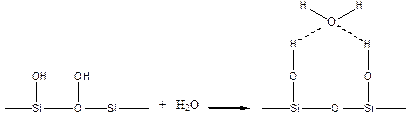
При адсорбции полимера, например, из водных растворов вода может играть роль активного конкурента полимера. Поэтому концентрация полимера должна быть значительно завышена, чтобы обеспечить его преимущественную сорбцию.
Водородную связь обнаруживают с помощью ИК-спектров.
Различают адсорбцию на поверхности раздела следующих фаз:
1) газ - твердое тело;
2) газ - раствор;
3) твердое тело - раствор;
4) адсорбция на поверхности двух несмешивающихся жидкостей (жидкость - раствор).
Дата добавления: 2015-08-08; просмотров: 3244;
