Идеал газ күйінің теңдеуі
Молекула-кинетикалық негізінде алынған теңдеулер газ күйін анықтайтын шамаларды өзара байланысатын қатарларды табуға мүмкіндік береді. Бұл шамаларға газдың қысымы 
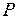 , оның температурасы
, оның температурасы 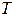 және газдың белгілі массасын алатын
және газдың белгілі массасын алатын 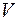 көлем жатады. Оларды күй параметрлері деп атайды. Бұл аталған үш шама өзара тәуелсіз емес. Олардың әрбіреуі қалған екеуінің функциясы болып табылады. Осы үш шамаларды – газдың белгілі массасы үшін оның қысымын, көлемін және температурасын байланыстырып тұратын теңдеуді күй теңдеуі деп атайды және оны жалпы түрде
көлем жатады. Оларды күй параметрлері деп атайды. Бұл аталған үш шама өзара тәуелсіз емес. Олардың әрбіреуі қалған екеуінің функциясы болып табылады. Осы үш шамаларды – газдың белгілі массасы үшін оның қысымын, көлемін және температурасын байланыстырып тұратын теңдеуді күй теңдеуі деп атайды және оны жалпы түрде 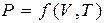 деп жазады.
деп жазады.
Идеал газдар үшін күй теңдеуін кинетикалық теорияның негізгі 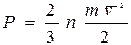 және
және 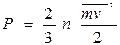 теңдеуінен жеп-жеңіл алуға болады. Егер
теңдеуінен жеп-жеңіл алуға болады. Егер 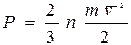 теңдеуге молекулаларының орташа кинетикалық энергиясының орнына оның
теңдеуге молекулаларының орташа кинетикалық энергиясының орнына оның 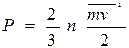 теңдеудегі мәнін қоятын болсақ, онда
теңдеудегі мәнін қоятын болсақ, онда
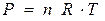 (10.6)
(10.6)
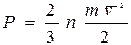 тең. Егер
тең. Егер 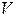 көлемде
көлемде 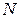 бөлшек болатын болса, онда
бөлшек болатын болса, онда 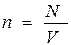 оны апарып (10.6) өрнекке қойсаң, мынаны көреміз:
оны апарып (10.6) өрнекке қойсаң, мынаны көреміз:
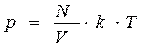
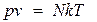 (10.7)
(10.7)
Бұл теңдеуге барлық үш күй параметрлері де кіреді, сондықтан да ол идеал газ күйінің теңдеуі болып табылады.
Моль деп көміртегінің изотопының 0,012 кг массасы қанша құрама элементтерден тұратын болса, сонша құрама элементтерден (атомдардан немесе молекулалардан) тұратын 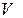 заттың мөлшерін атайды.Сонымен
заттың мөлшерін атайды.Сонымен 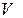 заттың бір молінде молекула (атомдардың) бірдей саны болады екен. Егер де қайсыбір екі заттың салыстырмалық массаларын
заттың бір молінде молекула (атомдардың) бірдей саны болады екен. Егер де қайсыбір екі заттың салыстырмалық массаларын 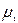 және
және 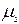 деп, ал осы заттардың молекулалық массаларын
деп, ал осы заттардың молекулалық массаларын 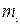 және
және 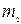 деп белгілеп
деп белгілеп
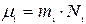 және
және 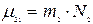 (10.8)
(10.8)
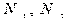 - осы заттардың моліндегі бөлшектер саны.
- осы заттардың моліндегі бөлшектер саны.
Салыстырмалық массалардың анықтамасынан (10.8) өрнегіндегі (1)-ші теңдікті (2)-ші теңдікке 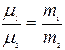 бөлетін болсақ, онда
бөлетін болсақ, онда 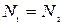 , яғни
, яғни 
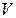 заттың молінде молекулалардың бірдей саны болады екен.
заттың молінде молекулалардың бірдей саны болады екен.
Барлық заттар үшін бірдей болатын бір молдегі бөлшектер саны – Авагадро саны деп аталады. Оны 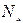 деп белгілейтін болсақ. Егер берілген заттың массасы
деп белгілейтін болсақ. Егер берілген заттың массасы 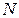 молекуладан тұратын болса, онда заттың берілген массасында, оның қанша молі бар екендігін білу үшін
молекуладан тұратын болса, онда заттың берілген массасында, оның қанша молі бар екендігін білу үшін 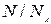 деп алсаң болғаны; бұл қатынас бізге заттың молдерінің
деп алсаң болғаны; бұл қатынас бізге заттың молдерінің 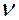 санын береді.
санын береді. 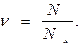 Егер осы қатынастың алымын да, бөлімін де молекуланың
Егер осы қатынастың алымын да, бөлімін де молекуланың 
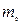 массасына көбейтіп,
массасына көбейтіп, 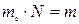 - берілген заттың массасы да,
- берілген заттың массасы да, 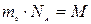 - заттың бір молінің массасы екендігін ескерсек, онда
- заттың бір молінің массасы екендігін ескерсек, онда 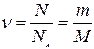 болатындығын көреміз. Осыдан
болатындығын көреміз. Осыдан 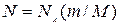 деп алып, оны (10.7) теңдікке қойсаң, онда:
деп алып, оны (10.7) теңдікке қойсаң, онда: 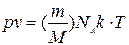 . Бұл теңдікке екі универсал тұрақты кіреді,
. Бұл теңдікке екі универсал тұрақты кіреді, 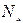 - Авагадро саны және
- Авагадро саны және 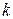 - Больцман тұрақтысы. Осы екі универсал тұрақтылардың көбейтіндісін
- Больцман тұрақтысы. Осы екі универсал тұрақтылардың көбейтіндісін 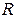 деп белгілейді және ол универсал газ тұрақтысы болады. Оның
деп белгілейді және ол универсал газ тұрақтысы болады. Оның 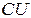 -дегі мәні
-дегі мәні 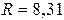 Дж/моль-К.
Дж/моль-К.
Енді идеал газ күйінің теңдеуін былай жаза аламыз:
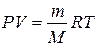 (10.9)
(10.9)
Бұл теңдеуді көбіне Клайперон-Менделеев теңдеуі деп атайды. Газдың бір молі үшін бұл теңдеу былай жазылады

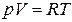 (10.10)
(10.10)
Дата добавления: 2015-08-08; просмотров: 5431;
