Первый закон химической термодинамики.
Первый закон химической термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем, в которых изменение энергии происходит в виде теплоты и работы.
Для любого процесса соблюдается равенство: Q = ΔU + A
Формулировка 1-ого закона химической термодинамики:
Если к системе подводится теплота, то она расходуется на изменение внутренней энергии системы и совершение системой работы.
U – внутренняя энергия. Под внутренней энергией подразумевается общий запас энергии, включая энергию межмолекулярного взаимодействия в среде, энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов и других частиц, за исключением кинетической и потенциальной энергии системы в целом.
Внутренняя энергия системы это функция состояния вещества, её изменение не зависит от пути перехода из одного состояния в другое.
Абсолютное значение внутренней энергии определить невозможно, можно определить только её изменение(DU).
В термодинамике обычно исследуют две формы передачи энергии от одной системы к другой – теплоту и работу.
Теплота (Q) – микроскопическая форма передачи энергии при столкновении хаотически движущихся молекул и атомов соприкасающихся тел.
Под работой (А) подразумевается работа системы против внешних сил (давления, электрических и магнитных полей и др.)
В отличие от внутренней энергии, работа и теплота не являются функциями состояния системы, они зависят от вида процесса.
Если система переходит из одного состояния характеризуемого объёма V1 в другое, с объёмом V2 то:
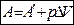 , где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
, где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
Если изучаемая система находится только под действием давления, то A = рDV, тогда 1-ый закон термодинамики имеет вид: 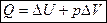 .
.
1) Для изохорных процессов (V=const, ΔV=0):
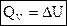 , т. е. теплота расходуется только на изменение внутренней энергии.
, т. е. теплота расходуется только на изменение внутренней энергии.
2) При постоянном давлении (изобарные процессы):
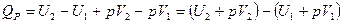
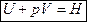 , где Н – энтальпия (теплосодержание системы), т. е.
, где Н – энтальпия (теплосодержание системы), т. е.
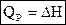
Энтальпия– функция состояния системы, она не зависит от пути перехода системы из одного состояния в другое. Абсолютное значение энтальпии определить невозможно, можно определить только её изменение. В термохимии изменение энтальпии называют тепловым эффектом реакции.
Энтальпия процесса 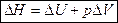
Дата добавления: 2015-08-08; просмотров: 672;
