Термохимия
Все химические процессы протекают либо с выделением, либо с поглощением тепла. Экзотермическими называют процессы, идущие с выделением тепла и эндотермическими – идущие с поглощением тепла. Количество выделяемой или поглощаемой теплоты называется тепловым эффектом реакции.
Для изохорных процессов тепловой эффект равен изменению внутренней энергии: 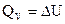 , для изобарных – изменению энтальпии:
, для изобарных – изменению энтальпии: 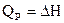 , т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
, т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
Химические уравнения, в которых указан тепловой эффект реакции при постоянном давлении и температуре, называются термохимическими уравнениями. Причём, в термодинамике все процессы рассматриваются со стороны самой системы: тепловой эффект считается положительным (DН > 0) для эндотермических процессов и отрицательным (DН < 0) для экзотермических процессов.
Тепловой эффект реакции при постоянном давлении (DН) измеряется в кДж, и относится к числу молей веществ, участвующих в реакции. Кроме того, в термохимических уравнениях указывают агрегатное состояние веществ, участвующих в реакции.
Энтальпия реакции приводится для стандартных условий: температуры 298°К и давления в 1 атм. = 101325 Па.
Изменение энтальпии может быть найдено не только для химических реакций, но и для других процессов – например, фазовых переходов. Фазовым переходом называют переход одной фазы в другую: твёрдое – жидкое (испарение), твёрдое – газ (сублимация или возгонка) и т. д.
Стандартная энтальпия образования сложного вещества - это тепловой эффект реакции образования 1-го моля сложного вещества из простыхвеществ.
Стандартная энтальпия разложения сложного вещества - это тепловой эффект реакции разложения 1-го моля сложного вещества на простые вещества.
Стандартная энтальпия образования 1-го моля сложного вещества равна стандартной энтальпии разложения 1-го моля вещества, взятого с обратным знаком – закон Лавуазье-Лапласа.
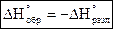 , где
, где 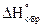 ,
, 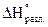 - энтальпии образования (разложения) сложного вещества при стандартных условиях.
- энтальпии образования (разложения) сложного вещества при стандартных условиях.
Энтальпия образования 1-го моля вещества приводится в таблицах и измеряется в 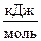 . Энтальпии образования простых веществ равны нулю.
. Энтальпии образования простых веществ равны нулю.
Дата добавления: 2015-08-08; просмотров: 622;
