Энергия молекулы
Молекулы состоят из одинаковых или различных атомов, соединенных между собой в одно целое силами связи, которые называют химическими связями.Силы, удерживающие атомы в молекуле, вызваны взаимодействием внешних электронов.
Различают два вида связи. Один из них осуществляется в тех молекулах, в которых часть внешних электронов движется вокруг обоих ядер (мы ограничимся рассмотрением только двухатомных молекул). Такая связь называется гомеополярной или ковалентной связью.К молекулам с такой связью относятся молекулы с одинаковыми ядрами (Н2, N2, O2) и молекулы с разными ядрами (например, CN).
Второй тип связи имеет место в том случае, когда электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого – их недостаток. Таким образом, молекула как бы состоит из двух ионов противоположных знаков, притягивающихся друг к другу. Этот тип связи называется гетерополярной или ионной.Примером молекулсионной связью могут служить NaCl, KBr, HCl и т. д.
Независимо от природы тех сил, которые приводят к образованию устойчивой системы из двух атомов можно высказать некоторые общие соображения о характере этих сил. Атомы, расположенные на значительном расстоянии друг от друга, не взаимодействуют дуг с другом. По мере уменьшения расстояния r между ядрами атомов возрастают силы взаимного притяжения, действующие между атомами (см. рис. 11.5, F2). Однако эти силы не являются единственными. На малых расстояниях между атомами проявляют свое действие силы взаимного отталкивания F1, не позволяющие электронам одного атома слишком глубоко проникнуть внутрь электронных оболочек другого атома. Силы отталкивания являются более короткодействующими, чем силы притяжения. Благодаря одновременному действию противоположено направленных сил – притяжения и отталкивания – на некотором расстоянии r0 между атомами обе силы уравновешивают друг друга и их геометрическая сумма (результирующая сила F) равна нулю.

|
 Этому расстоянию соответствует наименьшая взаимная потенциальная энергия Wп(r) атомов двухатомной молекулы. На рис. 11.6 приведена кривая зависимости от r потенциальной энергии Wп(r) взаимодействия двух атомов в молекуле. Равновесное междуатомное расстояние r0 в молекуле называют длиной связи. Величина D (на кривой рис. 11.6) определяет энергию связи молекулы. Она численно равна работе, которую надо совершить для того, чтобы разорвать связи атомов в молекуле.
Этому расстоянию соответствует наименьшая взаимная потенциальная энергия Wп(r) атомов двухатомной молекулы. На рис. 11.6 приведена кривая зависимости от r потенциальной энергии Wп(r) взаимодействия двух атомов в молекуле. Равновесное междуатомное расстояние r0 в молекуле называют длиной связи. Величина D (на кривой рис. 11.6) определяет энергию связи молекулы. Она численно равна работе, которую надо совершить для того, чтобы разорвать связи атомов в молекуле.

|
W = We + Wv + Wr , (11.4)
|
Используя уравнения квантовой механики, можно показать, что не только при изменении электронной конфигурации, но и при изменении энергии колебательного и вращательного движений, энергия указанных видов движения имеет дискретные значения и может быть выражены следующим образом:
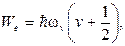 (11.5)и
(11.5)и 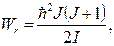 (11.6)
(11.6)
 где v – колебательное квантовое число, которое может принимать следующие значения:
где v – колебательное квантовое число, которое может принимать следующие значения:
v = 0, 1, 2, 3, …; ωv – циклическая частота колебаний; J – вращательное квантовое число, которое может принимать следующие значения: J = 0, 1, 2, 3, …; I – момент инерции молекулы относительно оси, проходящий через центр инерции.
|
Итак, в соответствии с (11.5)и (11.6)полнаяэнергия молекулы равна:

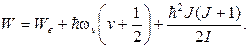
Опыт и теория показывают, что расстояние между вращательными уровнями ∆Wr значительно меньше расстояния между колебательными уровнями ∆Wv, которое в свою очередь значительно меньше, чем расстояние между электронными уровнями ∆Wе. Таким образом, схема энергетических уровней молекулы выглядит так, как показано на рис.11.9 (приведены только два электронных уровня). Совокупность уровней содержится в правом столбце рисунка. Первые два столбца лишь поясняют возникновение уровней.
|
молекулярные же спектры состоят из полос, резких с одного края и размытых с другого. При изучении этих спектров с помощью приборов с большой разрешающей способностью определяют важнейшие физические характеристики молекул: длину связи, энергию связи, момент инерции.
Дата добавления: 2015-08-08; просмотров: 790;
