Состояния электронов в атоме. Принцип Паули. Структура многоэлектронного атома
Условие, в котором находится электрон в атоме, называют электронным состоянием. Это состояние определяется набором четырех квантовых чисел: n, l, mlи ms. Их называют: n– главное квантовое число, l– орбитальное квантовое число, ml– магнитное квантовое число (или магнитно-орбитальное квантовое число), ms– магнитно-спиновое квантовое число. Введение этих квантовых чисел обусловлено тем, что электрон атома, находясь в определенном состоянии, характеризуется определенными значениями энергии, орбитальным и спиновым моментами импульса, орбитальным и спиновым магнитными моментами и проекциями этих величин на направление магнитного поля. Квантовые числа могут принимать следующие значения:
n– 1, 2, 3, …, ∞;
при заданном значении n, lможет принимать только следующие значения:
l– 0, 1, 2, 3, … n-1;
при заданном значении l, mlможет принимать только следующие значения:
ml - l, -l+ 1, -l+ 2, -l+ 3, … 0, 1, 2, 3, … l(2l+ 1) – значение;
ms- ± 1/2 (только два значения).
Согласно принципу Паули в атоме не может быть двух электронов, находящихся в одинаковом состоянии, или в атоме не может быть двух электронов характеризующихся одинаковым набором четырех квантовых чисел.
Для энергетической характеристики свободных атомов (атомов, на которые не действуют внешнее поле) электронные состояния этих атомов принято обозначать с помощью квантовых чисел nи l. При этом квантовые числа nобозначают цифрами, а l– буквами в следующем соответствии:
l– 0, 1, 2, 3, … n-1;
s, p, d, f, …
У электронов атома возможны следующие электронные состояния:
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
- - - -
Схема возможных энергетических уровней электронов в атоме приведена на рис. 11.1.
| 2p | n | l | ml | ms |
| 1/2 | ||||
| -1/2 | ||||
| 1/2 | ||||
| -1/2 | ||||
| -1 | 1/2 | |||
| -1 | -1/2 |
 Каждый из указанных уровней включает в себя 2(2l+ 1) состояний. Например, уровень энергии 2pвключает в себя 6 состояний с указанным в таблице набором квантовых чисел.
Каждый из указанных уровней включает в себя 2(2l+ 1) состояний. Например, уровень энергии 2pвключает в себя 6 состояний с указанным в таблице набором квантовых чисел.
В свободном атоме, электроны,
|
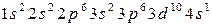 .
.
Записанное выражение называют электронной конфигурацией атома, которая указывает на структуру распределения электронов по оболочкам и подоболочкам. Электроны с одинаковым значение nобразуют оболочку атома. Различают следующие оболочки:
n 1 2 3 4 …
Число электронов
в оболочке (2n2) 2 8 18 32
Условное
обозначение K L M L
Электроны, которые характеризуются одинаковыми значениями n и lобразуют подоболочку. Число электронов в подоболочке равно 2(2l+ 1). Итак, у атома Cu, находящегося в свободном состоянии, электроны заполнили полностью K, L, и Mоболочки, внешний (валентный) электрон находится в состоянии 4s. Если возбудить атом (сообщить ему незначительное количество энергии), то изменит свою энергию прежде всего внешний электрон, перейдя, например, в состояние 4pи электронная конфигурация у атома примет выражение:  .Для вывода электронов из полностью заполненных оболочек потребуется сообщить атому значительную долю энергии (используя, например, рентгеновское или гамма излучение).
.Для вывода электронов из полностью заполненных оболочек потребуется сообщить атому значительную долю энергии (используя, например, рентгеновское или гамма излучение).
Дата добавления: 2015-08-08; просмотров: 912;
