Химические свойства. Химические свойства алкенов определяются наличием в их молекулах двойной связи
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом АЕ (от англ. addition electrophilic). Реакции электрофильного присоединения – это ионные процессы, протекающие в несколько стадий.
На первой стадии электрофильная частица (чаще всего это бывает протон Н+) взаимодействует с π-электронами двойной связи и образует π-комплекс, который затем превращается в карбокатион путем образования ковалентной σ-связи между электрофильной частицей и одним из атомов углерода:
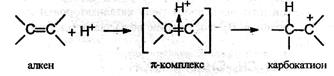
На второй стадии карбокатион реагирует с анионом X , образуя вторую σ-связь за счет электронной пары аниона:
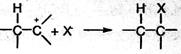
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением л- электронной плотности под влиянием заместителей:
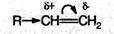
Электронодонорные заместители, проявляющие +I-эффект, смещают π-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд.
Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ (X = Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr)образуются алкилгалогениды:
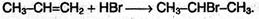
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
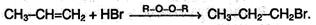
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
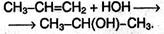
3) Галогенирование. Алкены обесцвечивают бромную воду:

Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит в присутствии металлических катализаторов:
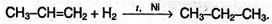
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АЕ:
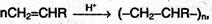
Где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение – полимером, число п – степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления.При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
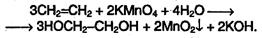
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
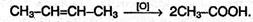
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
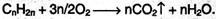
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
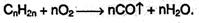
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:
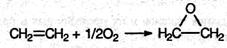
При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлорметане при температурах ниже комнатной, то происходит реакция присоединения и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой – при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
Дата добавления: 2015-08-08; просмотров: 1595;
