Номенклатура и изомерия. Алкенами называют непредельные углеводороды, молекулы которых содержат одну двойную связь
Алкенами называют непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса – этилен СН2=СН2, в связи с чем алкены также называют этиленовыми углеводородами. Ближайшие гомологи этилена:

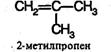
Простейший алкен с разветвленным углеродным скелетом:
Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалканов, поэтому алкены и циклоалканы являются межклассовыми изомерами.
Валкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
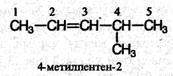
При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnН2n-1, простейшие из которых – винил (этенил) и аллил (пропенил):

Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Три σ-связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу; π-связь образована при перекрывании негибридных 2p-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Такое «боковое» перекрывание менее эффективно, чем осевое, и, следовательно, π-связь является менее прочной, чем σ-связь. Дополнительное π-связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием σ- и π-связей. Длина двойной связи С=С составляет 0,133 нм, что существенно меньше длины одинарной связи (0,154 нм). Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии одинарной связи (347·2 = 694 кДж/моль); это обусловлено меньшей энергией π-связи.
Структурная изомерия алкенов обусловлена изомерией углеродного скелета (например, бутен-1 и 2-метилпропен) и изомерией положения двойной связи (бутен-1 и бутен-2). Пространственная, или цис- транс- изомерии обусловлена различным положением заместителей относительно плоскости двойной связи. Этот вид изомерии рассмотрим подробнее.
Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс-изомер), например:
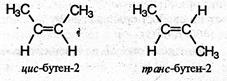
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс- изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис- транс- изомеров.
Дата добавления: 2015-08-08; просмотров: 1037;
