Химические свойства. В обычных условиях алканы химически инертны
В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия КМnO4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью σ-связей С–С и С–Н, а также их неполярностью. Неполярные связи С–С и С–Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR(от англ. substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
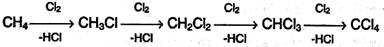
Реакция имеет цепной характер. В цепной реакции выделяют несколько стадий: инициирование (зарождение цепи), рост цепи и обрыв цепи.

Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.Н. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140 °С и небольшом давлении протекает радикальная реакция:
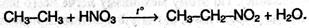
Как отмечено выше, при радикальных реакциях (галогенирование, нитрование) в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем – вторичного (390 кДж/моль) и только потом – первичного (415 кДж/моль).
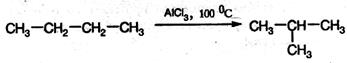
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
4. Крекинг – это гемолитический разрыв связей С–С, который протекает при нагревании и под действием катализаторов. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
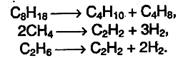
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
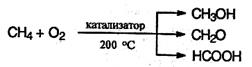
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
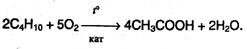
Мягкое каталитическое окисление бутана кислородом воздуха – один из промышленных способов получения уксусной кислоты:
На воздухе алканы сгорают до СО2 и Н2О:
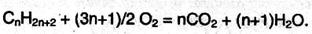
Дата добавления: 2015-08-08; просмотров: 2253;
