РАННЕЕ РАЗВИТИЕ МОЗГА
Процессы нейруляции и морфогенеза нервной ткани контролируются молекулярными сигналами. Они модулируют экспрессию генов в клетках-мишенях. Одним из первых подобных сигналов была идентифицирована ретиноевая кислота, дериват витамина А и молекула надсемейства стероидных/тиреоидных гормонов. Ретиноевая кислота активирует рецепторы ретиноидов, которые служат транскрипционными факторами, контролирующими экспрессию конкретных генов-мишеней (рис. 8-5). К пептидным сигналам нейральной индукции и дифференцировки нервных структур относят Sonic hedgehog (Shh), представителей семейства Wnt, факторы роста фибробластов (FGF), ряд представителей семейства трансформирующего фактора роста b (TGFb), включающего морфогенетические белки кости (BMP). Источником этих сигналов служит хорда, вентральная часть нервной трубки, сама нейроэктодерма, а также сомиты. Рецепторы пептидных сигналов FGF и BMP обладают протеинкиназной активностью. FGF связывается со своей рецепторной тирозинкиназой, кооперируя с компонентами внеклеточного матрикса, например гепарансульфат протеогликаном. При связывании с лигандом в рецепторе активируется внутриклеточный киназный домен с последующей активацией RAS/MAP киназного пути. Это приводит к модификации цитоплазматических компонентов и цитоскелета, изменению формы и подвижности клетки или влияет на её пролиферативную активность. Рецепторами BMP служат серин/треониновые киназы, которые фосфорилируют группу цитоплазматических белков, называемых SMAD. После фосфорилирования мультимеры SMAD транслоцируются в ядро, где модулируют экспрессию генов. Механизм действия некоторых сигналов представляется более сложным. Передача информации при помощи сигнала Shh оказывается возможной только при кооперативном взаимодействии двух поверхностных рецепторов (Patched и Smoothened) (рис. 8-5). После взаимодействия с лигандом рецепторный комплекс интернализуется и в цитоплазме поддерживает транслокацию в ядро транскрипционных факторов, включая Gli1, с последующей модуляцией экспрессии генов. Действие на клетку-мишень молекулы Wnt опосредовано рецепторами, относящимися к семейству белков frizzled. Связывание лиганда с рецептором вызывает деградацию присутствующего в цитоплазме белкового комплексаAPC/аксин, который в обычных условиях предотвращает транслокацию в ядро b–катенина. Проникший в ядро b–катенин влияет на экспрессию ряда эффекторных генов.
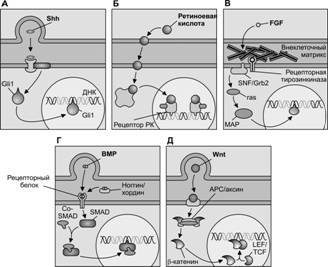
Рис. 8-5. Главные индуцирующие сигналы контроля экспрессии генов при закладке нейроэктодермы и последующей дифференцировке нейронов и глиальных клеток:Sonic Hedgehog (Shh) (А), ретиноевая кислота (Б), фактор роста фибробластов (FGF) (В), представители надсемейства трансформирующего фактора роста b (TGFb) — морфогенетические белки кости (BMP) (Г), молекулы семейства Wnt (Д). [128]
Градиенты вышеупомянутых морфогенов и нейральных индукторов определяют спецификацию частей будущего мозга по дорсо-вентральной (рис. 8-6) и кранио-каудальной оси. Региональная спецификация развивающегося мозга по кранио-каудальной оси начинается очень рано. Головной отдел нервной трубки формирует передний мозг (prosencephalon), средний мозг (mesencephalon) и ромбовидный мозг (rhombencephalon).
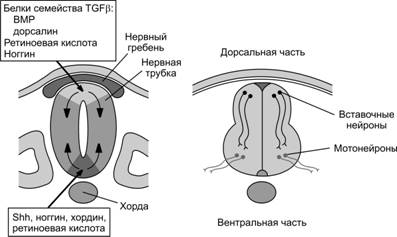
Рис. 8-6. Градиенты локальных индуцирующих сигналов, определяющих спецификацию частей нервной трубки по осям и судьбу клеток в определенных её частях.В области хорды и вентральной части нервной трубки экспрессируется молекула Shh. Присутствие антагонистов TGFb ноггина и хордина, а также ретиноевой кислоты, ограничено областью противоположных полюсов (дорсального и вентрального) нервной трубки. Эти факторы экспрессируются только в вентральной и дорсальной части нервной трубки. Исключительно для дорсальной части нервной трубки характерна экспрессия белков семейства BMP и дорсалина. Подобное неравномерное распределение указанных молекулярных факторов лежит в основе спецификации нейронов, локализованных в различных частях нервной трубки — спинного мозга: в дорсальной части локализуются перикарионы интернейронов (вставочных нейронов), направляющие отростки в таламус, а в вентральной части — мотонейроны, аксоны которых покидают спинной мозг и направляются в скелетную мышцу, где образуют нервно-мышечные синапсы. [128]
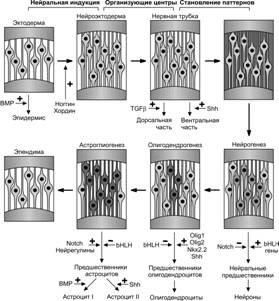
Рис. 8-7. Молекулярные и клеточные механизмы контроля дифференцировки нейронов и глии.На ранних стадиях популяция клеток дорсальной эктодермы реагирует на соотношение BMP и их антагонистов — ноггина и хордина. Молекулы BMP поддерживают дифференцировку эпидермиса. В ходе нейральной индукции антагонисты ноггин и хордин снимают влияние BMP, что определяет формирование нервной пластинки. На этой стадии нейруляции начинают действовать другие факторы, которые определяют спецификацию нейронов для конкретных областей будущего мозга: в дорсальной части трубки — принадлежащие семейству TGFb, а в вентральной — Shh. На последующих стадиях формируются диффероны для нейронов и глиальных клеток. Нейральный дифферон контролируется балансом между действием факторов Notch (тормозящее влияние) и экспрессией генов bHLH (активирующее влияние). Дифференцировку олигодендроцитов и астроцитов ингибируют продукты генов bHLH. Формирование олигодендроцитов поддерживают транскрипционные факторы Olig1, Olig2 и Nkx2.2, а астроцитов Notch и нейрегулины. Контакт клеток–предшественниц с внутренней (вентрикулярной) поверхностью нервной трубки определяет их дифференцировку в направлении образования эпендимы. В этом слое зрелого мозга предполагается присутствие стволовых нейральных клеток. Секреторные сигнальные молекулы из семейства морфогенетического белка кости (BMP) поддерживают дифференцировку предшественников глии в астроциты типа I. Под влиянием другого секреторного белка Shh предшественники глии дифференцируются в астроциты типа II и олигодендроциты. [128]
Морфогенез
Морфогенетические процессы — индукция, адресная миграция клеток, направленный рост аксонов, гибель клеток, так называемые нейротрофические взаимодействия — хорошо выражены в развивающейся нервной системе. Жёсткость организации мозга определяют два момента: адресная миграция клеток и направленный рост их отростков.
Дата добавления: 2015-07-07; просмотров: 1138;
