Рабочие кардиомиоциты
Кардиомиоциты — морфо-функциональные единицы сердечной мышечной ткани, имеют цилиндрическую ветвящуюся форму диаметром около 15 мкм (рис. 7-22). При помощи межклеточных контактов (вставочные диски) рабочие кардиомиоциты объединены в так называемые сердечные мышечные волокна — функциональный синцитий (рис. 7-21А) — совокупность кардиомиоцитов в пределах каждой камеры сердца. Клетки содержат центрально расположенные, вытянутые вдоль оси одно или два ядра, миофибриллы и ассоциированные с ними цистерны саркоплазматического ретикулума (депо Ca2+). Многочисленные митохондрии залегают параллельными рядами между миофибриллами. Их более плотные скопления наблюдают на уровне I-дисков и ядер. Гранулы гликогена сконцентрированы на обоих полюсах ядра. Митохондрии и запасы гликогена поддерживают окислительный метаболизм. Т-трубочки в кардиомиоцитах — в отличие от скелетных мышечных волокон — проходят на уровне Z-линий. В связи с этим Т-трубочка контактирует только с одной терминальной цистерной. В результате вместо триад скелетного мышечного волокна формируются диады.
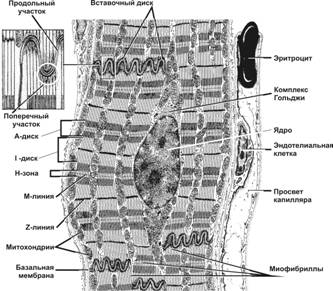
Рис.7-22.Рабочий кардиомиоцит — удлинённой формы клетка. Ядро расположено центрально, вблизи ядра находятся комплекс Гольджи и гранулы гликогена. Между миофибриллами лежат многочисленные митохондрии. Вставочные диски (на врезке) служат для скрепления кардиомиоцитов и синхронизации их сокращения. [17]
Сократительный аппарат.Организация миофибрилл и саркомеров в кардиомиоцитах такая же, что и в скелетном мышечном волокне. Одинаков и механизм взаимодействия тонких и толстых нитей при сокращении.
Сердечные миозины. Существует несколько генов для лёгких и тяжёлых цепей сердечного миозина, различающихся по активности АТФазы. В зрелом миокарде преимущественно синтезируется тяжёлая цепь сердечного миозина с низкой АТФазной активностью, в отличие от цепи, обладающей высокой АТФазной активностью.
Гипертрофическая кардиомиопатия — гетерогенная группа наследственных заболеваний. Мутации генов тяжёлой цепи сердечного миозина (40%), С–белка (42%), TnT, тропомиозина сопровождаются гипертрофией кардиомиоцитов и дезорганизацией сердечных мышечных волокон.
Тропонины. Изоформа тропонина С сходна с TnC1, экспрессирующегося в медленных скелетных мышечных волокнах. TnI характеризуется высокой специфичностью для сердечной мышцы.
Саркоплазматическая сеть. Выход Ca2+ из саркоплазматического ретикулума регулируется через рецепторы рианодина (RyR2). Изменения мембранного потенциала открывают потенциалозависимые Ca2+-каналы, в кардиомиоцитах незначительно повышается концентрация Ca2+. Этот Ca2+ активирует рецепторы рианодина, и Ca2+ из депо выходит в цитозоль (кальций-индуцированная мобилизация Ca2+). В момент расслабления кардиомиоцитов Ca2+-АТФаза SERCA2a закачивает Ca2+ в саркоплазматический ретикулум, где ионы Са2+связывает сердечная изоформа белка кальсеквестрина. Фосфоламбан регулирует активность SERCA2a. Нефосфорилированная форма фосфоламбана блокирует SERCA2a. Норадреналин через цАМФ-зависимую протеин киназу А путём фосфорилирования фосфоламбана снимает ингибирующий эффект фосфоламбана на Ca2+-АТФазу, облегчая таким образом процесс расслабления мышечного волокна и увеличивая эффективность сокращения. Для предотвращения избыточного депонирования Ca2+ те катионы, которые проникли в клетку через плазмолемму, должны быть выведены во внеклеточное пространство.Натрий-кальциевый анионообменник осуществляет обмен внутриклеточного Ca2+ на внеклеточный Na+.
Мутация гена фосфоламбана является одной из причин дилатационной кардиомиопатии, характеризующейся диффузным поражением миокарда с дилатацией (расширением) полостей сердца и резким снижением сократительной функции сердца.
Йодсодержащие гормоны Т3 и Т4 активируют гены, кодирующие Са2+-АТФазу, Na+,K+-АТФазу, 1-адренорецептор, транспортёр глюкозы, предсердный натриуретический пептид. При повышенном содержании в крови Т3 и Т4 в кардиомиоцитах подавляется синтез тяжёлой -цепи и увеличивается экспрессия гена, кодирующего тяжёлую -цепь сердечного миозина.
Вставочные диски. На концах контактирующих кардиомиоцитов имеются интердигитации (пальцевидные выпячивания и углубления). Вырост одной клетки плотно входит в углубление другой. На конце такого выступа (поперечный участок вставочного диска) сконцентрированы контакты двух типов: десмосомы и промежуточные. На боковой поверхности выступа (продольный участок вставочного диска) имеется множество щелевых контактов (nexus, нексус), передающих возбуждение от кардиомиоцита к кардиомиоциту.
Десмосомы обеспечивают механическое сцепление, препятствующее расхождению кардиомиоцитов при сокращении.
Промежуточные контакты необходимы для прикрепления тонких актиновых нитей ближайшего сaркомера к сарколемме кардиомиоцита.
Щелевые контакты (nexus) — межклеточные ионные каналы — образуют электрические синапсы, проводящие возбуждение от кардиомиоцита к кардиомиоциту. Это обстоятельство — наряду с проводящей системой сердца — позволяет синхронизировать одновременное сокращение множества кардиомиоцитов в составе функционального синцития.
Синхронизация сокращения кардиомиоцитов. Распространение волны деполяризации по сердечным мышечным волокнам обеспечивают электрические синапсы между смежными кардиомиоцитами. Внутриклеточный и внеклеточный потоки ионов, обеспечивающие генерацию потенциала действия и синхронизацию сокращения сердечной мышцы, лежат в основе электромиографического исследования миокарда (рис. 7-23).
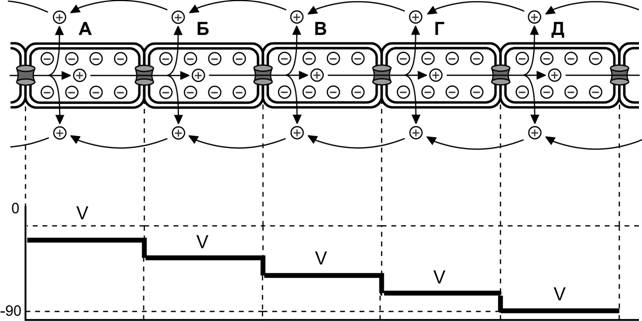
Рис. 7-23. Проведение возбуждения между кардиомиоцитами.Положительно заряженные ионы из кардиомиоцита А, в котором возник потенциал действия, через электрические синапсы переходят в смежные клетки (Б, В, Г, Д), вызывая в них деполяризацию (V). Степень деполяризации кардиомиоцитов зависит от расстояния между клетками и приближающейся волной возбуждения. В кардиомиоците (Б) деполяризация активирует потенциалозависимые Na+- и Ca2+-каналы. Поступившие в цитозоль внеклеточные Na+ и Ca2+ приближают деполяризацию мембраны к критическому порогу возникновения потенциала действия и увеличивают внутриклеточный поток положительно заряженных ионов, распространяющийся далее по клеткам (В, Г, Д) впереди волны возбуждения. При этом в результате деполяризации ассоциированные с мембраной положительно заряженные ионы выходят из кардиомиоцитов во внеклеточное пространство и перемещаются в обратном внутриклеточному току направлении. [114]
Предсердные и желудочковые кардиомиоциты. Предсердные и желудочковые кардиомиоциты относятся к разным популяциям рабочих кардиомиоцитов. Предсердные кардиомиоциты относительно мелкие, 10 мкм в диаметре и длиной 20 мкм. В них слабее развита система Т-трубочек, но в зоне вставочных дисков значительно больше щелевых контактов. Желудочковые кардиомиоциты крупнее (25 мкм в диаметре и до 140 мкм в длину), они имеют хорошо развитую систему Т-трубочек. В состав сократительного аппарата миоцитов предсердий и желудочков входят разные изоформы миозина, актина и других контрактильных белков.
Секреторные кардиомиоциты. В части кардиомиоцитов предсердий (особенно правого) у полюсов ядер располагаются хорошо выраженный комплекс Гольджи и секреторные гранулы, содержащие атриопептин — гормон, регулирующий АД. При повышении АД стенка предсердия сильно растягивается, что стимулирует предсердные кардиомиоциты к синтезу и секреции атриопептина, вызывающего снижение АД.
Дата добавления: 2015-07-07; просмотров: 7426;
