Связь энтропии с другими термодинамическими параметрами
Для того, чтобы решить конкретную задачу, связанную с применением энтропии, надо установить зависимость между ней и другими термодинамическими параметрами. Уравнение dS = δQ/T в сочетании с δQ = dU + PdV и δQ = dH – VdP дает уравнения:
dU = TdS – PdV,
dH = TdS + VdP.
Записав уравнение:
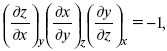
применительно к функциональной зависимости φ(Т, V, S) = 0, получим
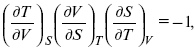
т. е.
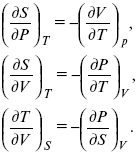
Теперь найдем зависимость энтропии от температуры из уравнений:
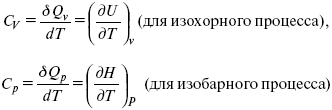
и
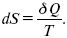
Вот эти зависимости:
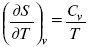
и
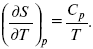
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
TdS = CdT.
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные– процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные– процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Дата добавления: 2015-08-08; просмотров: 858;
