Образование коллагеновых волокон
На внутриклеточном этапе в гранулярной эндоплазматической сети происходит синтез и сборка про-‑цепей (рис. 6-27). Далее в цистернах комплекса Гольджи осуществляется гидроксилирование и гликозилирование полипептидов, в результате чего образуются спирали из трёх про--цепей (проколлаген). В образовании про--цепей проколлагена участвуют ферменты пептидил пролин гидроксилаза и пептидил лизин гидроксилаза. Каждая про--цепь содержит концевые участки — регистрационные пептиды. Эти пептиды предотвращают внутриклеточное объединение спиралей проколлагена в коллагеновые фибриллы. Молекулы проколлагена накапливаются в секреторных гранулах и выделяются во внеклеточное пространство. Вне клетки регистрационные пептиды молекулы проколлагена отщепляются при помощи проколлагеновой пептидазы (образующуюся молекулу иногда называют тропоколлагеном). Это отщепление не происходит у коллагенов типов IV и V, чем и объясняется отсутствие фибрилл, построенных из коллагенов этих типов. Далее происходит сборка коллагеновых фибрилл (рис. 6-28). Молекулы тропоколлагена имеют хвостовой и головной концы и спонтанно объединяются в параллельно расположенные цепи, выстраиваясь последовательно: «конец в конец» и «сторона к стороне». При этом между головными и хвостовыми концами остаются зазоры шириной 35 нм. Каждая молекула тропоколлагена в цепи смещена относительно молекулы в соседней цепи на четверть её длины, что и служит причиной чередования тёмных и светлых полос с периодичностью 65 нм. Более толстые фибриллы образуются путём присоединения новых молекул тропоколлагена. В формировании поперечных связей между молекулами тропоколлагена участвует медь-содержащий фермент лизилоксидаза. Взаимодействие коллагена с гликозаминогликанами и фибронектином регулирует сборку фибрилл. Коллагеновое волокно формируется из многих параллельно связанных гликопротеинами коллагеновых фибрилл. Пучки коллагеновых волокон — погружённая в межклеточный матрикс совокупность коллагеновых волокон.
Витамин С — один из кофакторов, необходимых для образования поперечных связей между полипептидными цепями. Витамин С активирует пептидил пролин гидроксилазу и пептидил лизин гидроксилазу, — ферментов, участвующих в образовании про--цепей проколлагена. Дефицит витамина C приводит к формированию слабо гидроксилированных про-‑цепей, не способных формировать тройные спирали и коллагеновые фибриллы. В результате возникают дефекты костей, зубов, сосудистой стенки.
Дефекты фибрилл. Чрезмерное удлинение фаланг (арахнодактилия) и их эластичность, повышенная растяжимость кожи, частые сосудистые аневризмы при синдроме Марфана обусловлены нарушением образования поперечных связей при формировании коллагеновых фибрилл.
СиндромЭлерса-Данло.В результате генетического дефекта пептидил лизин гидроксилазы нарушается синтез коллагенов типов I и III, что приводит к появлению разрывов в стенке кишки или/и крупных артерий, где ретикулиновые волокна образуют оболочку вокруг ГМК, вызывает гиперподвижность суставов, гиперэластичность и ранимость кожи.
Синдром Олпорта.Мутация гена коллагена типа IV характеризуется прогрессирующей нефропатией (почечная недостаточность) и глухотой, связанной с поражением слухового нерва.
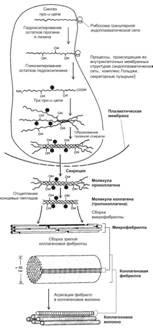
Рис. 6-27. Образование коллагенового волокна. Синтез полипептидных ‑цепей, их гидроксилирование и гликозилирование, а также образование спирали из трех ‑цепей происходят в гранулярной эндоплазматической сети и комплексе Гольджи. Молекулы проколлагена накапливаются в секреторных пузырьках и выделяются во внеклеточное пространство. Вне клетки от полипептидов отщепляются концевые пептиды и формируются коллагеновые фибриллы. [17]
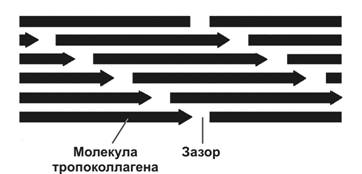
Рис. 6-28. Упаковка поляризованных молекул тропоколлагена при образовании коллагенового волокна. При последовательном объединении молекул в цепь между хвостовым и головным концами соседних молекул сохраняется зазор шириной 35 нм. Каждая молекула одной цепи смещена относительно молекулы соседней цепи на четверть её длины. Так формируется коллагеновая фибрилла, имеющая поперечную исчерченность с периодичностью 65 нм. [17]
Взаимодействие коллагена с клетками (табл. 6-12). Коллагеновые волокна окружают многие клетки. Некоторые клетки (например, гепатоциты и ГМК) имеют рецепторы коллагена и прямо связываются с ним. Другие клетки связываются с коллагеном через специальные связующие белки-посредники (чаще фибронектин, реже хондронектин и ламинин).
Фиброзы. При фиброзах содержание коллагена значительно возрастает. Так, синтез и содержание коллагена I типа увеличиваются при прогрессирующем системном склерозе, при образовании келоидов. Фиброзная ткань, грануляционная ткань, соединительнотканный рубец, келоидный рубец, келоид фактически состоят из коллагенов.
Воспаление и регенерация. При воспалении и регенерации происходит активная перестройка коллагена. Коллагеназы фибробластов, макрофагов и нейтрофилов разрушают коллаген, далее механоциты (синтезирующие коллаген клетки системы тканей внутренней среды) синтезируют коллагены, и происходит восстановление волокон.
Несовершенный остеогенез разных типов. Не менее 50 разных мутаций гена COL1A1, около 30 — генаCOL1A2.
Ахондрогенезы и ахондроплазии, приводящие к разным формам карликовости (мутации генов COL2A1 иCOL1A1).
Элерса-Данло синдромразвивается вследствие мутаций генов COL3A1 (не менее 30), COL1A1, COL1A2.
Таблица 6-12. Связующие молекулы между коллагеном и различными типами клеток
| Тип коллагена | Связующая молекула | Клеточный тип |
| I | Фибронектин | Разные типы |
| II | Хондронектин | Хондроциты |
| III | Фибронектин | Ретикулярные клетки, ГМК |
| IV | Ламинин | Эпителиальные клетки |
Дата добавления: 2015-07-07; просмотров: 6168;
