ПРОМЕЖУТОЧНЫЙ КОНТАКТ
Мембраны соседних клеток разделены промежутком шириной 10-20 нм, заполненным аморфным или фибриллярным материалом. Электроноплотная пластинка на цитоплазматической стороне клеточной мембраны в пределах контакта содержит белки плакоглобин, винкулин, –актинин и радиксин. В пластинку вплетены концы актинсодержащих микрофиламентов. В образовании контакта участвуют трансмембранные белки адгезии из семейства кадгерина.
Цепь молекулярных взаимодействий выглядит следующим образом: актин (примембранные микрофиламенты) — -актинин — винкулин — Е-кадгерин (трансмембранный гликопротеин адгезии). Е-кадгерин в присутствии Ca2+ прочно связывает мембраны соседних клеток. Цепь молекулярных взаимодействий в промежуточном контакте, начиная с актина микрофиламентов и до винкулина включительно, аналогична таковой в точечном (фокальном) адгезионном контакте. Если винкулин фокального контакта взаимодействует с трансмембранными белками-рецепторами (интегрины), то в промежуточном контакте он связывается с E-кадгерином.
В промежуточном контакте E-кадгерин связан с актиновым цитоскелетом через периферические мембранные белки, в том числе -, - и –катенины, –актинин и винкулин. -Катенин взаимодействует с цитоплазматическим участком E-кадгерина и связывает E-кадгерин с –катенином, который связан непосредственно с F–актином. –Актинин и винкулин — также F–актин связывающие белки, прямо связанные с –катенином. Связь E-кадгерина с актиновым цитоскелетом через эти мембранные белки усиливает межклеточную адгезионную активностьE-кадгерина.
Другая молекула межклеточной адгезии, нектин, через белок афадин также связана с F–актином цитоскелета (рис. 4-7). Нектины (нектин-1, -2, -3 и -4) — Ca2+-независимые белки семейства иммуноглобулинов. Молекула нектинов имеет внеклеточный домен с тремя петлями, одним трансмембранным участком и цитоплазматическим участком. Молекула нектинов (за исключением -1, -3 и -4) содержит мотив из 4 аминокислотных остатков (Glu/Ala-X-Tyr-Val) на COOH–конце, и этот мотив связывается с PDZ-доменом афадина.
Афадин (белок AF6) связывает нектин с актиновым цитоскелетом (рис. 4-7). Необходим для совместной организации нектина и E-кадгерина в промежуточном контакте. Афадин содержит два Ras-ассоциированных домена, forkhead-ассоциированный домен, DIL-домен, PDZ-домен и богатые пролином (PR) домены. F–актин связывается с участком молекулы, содержащим третий PR-домен. Афадин связан с цитоплазматическим участком нектина и, через F–актинсвязывающий домен, с F–актином. Дефект гена AF-6 (хромосомная аберрация) проявляется при острой миелоидной лейкемии.
ADIP (Afadin DIL domain-Interacting Protein, SSX2-SSX2-interacting protein) — широко распространённый белок адгезии, участвующий в организации и присутствующий в промежуточных адгезионных контактах, связывает афадин и –актинин (рис. 4-7). Молекула содержит три биспиральных участка, состоит из 615 аминокислот, Mr70,954 . ADIP объединяет комплексы нектин–афадин и E-кадгерин–катенин с участием –актинина. Кроме того,ADIP участвует в организации актинового цитоскелета в области промежуточного контакта через афадин и –актинин.

Рис. 4-7. Промежуточный контакт. Взаимодействие между системами нектин–афадин и кадгерин–катенин. Белок адгезии ADIP соединяет–актинин с афадином. Афадин связывает нектин, понзин, ADIP через различные участки молекулы: нектин связывается с PDZ-доменом, понзин — с третьим богатым пролином (PR) доменом, ADIP связывается с DIL-доменом. Афадин напрямую может связывается с –катенином. Таким образом, F–актин связывающий белок афадин может служить как опора для организации различных белков в опосредованном нектином межклеточном адгезионном контакте. [44]
Функция. Промежуточный контакт скрепляет не только мембраны соседних клеток, но и стабилизирует их цитоскелет, объединяя клетки с их содержимым в единую жёсткую систему.
Примеры: каёмчатый эпителий кишки (этот тип контактов известен как опоясывающая десмосома, т.к. контакт образует сплошной поясок вокруг клетки); секреторный эпителий (ацинозные клетки экзокринной части поджелудочной железы); вставочные диски в миокарде; эпендимные клетки ЦНС.
Десмосома
Десмосома (рис. 4-8) — самый распространённый и наиболее сложно организованный тип межклеточных контактов. Объединяет две формы соединений. Одна из них (цитоплазматическая пластинка) осуществляет связь промежуточных филаментов клетки с плазматической мембраной; вторая — связь плазматической мембраны с внеклеточным межмембранным материалом (десмоглеей) в пределах десмосомы.
Структура. Участки клеточных мембран, входящие в состав десмосомы, разделены слоем десмоглеи толщиной 20–30 нм. С внутренней стороны к плазматической мембране примыкает цитоплазматическая пластинка толщиной 10–40 нм с вплетёнными в неё промежуточными филаментами. В десмосомах всех клеточных типов присутствуют следующие белки: плакоглобин, десмоплакины, десмоглеины, десмоколлины.
Плакоглобин (синонимы — DP3, PKGB, PDGB, –катенин, десмоплакин III, DP3) — белок цитоплазматической пластинки десмосом и промежуточных контактов. Плакоглобин относится к семейству катенинов, образует комплекс с кадгерином, опосредуя связь с актиновыми филаментами. Плакоглобин также связывается с цитоплазматическим доменом десмоглеина I. Мутация гена плакоглобина приводит к развитию болезни (синдрома) Наксоса. Болезнь Наксоса — аутосомно-рецессивное расстройство, проявляющееся в неэпидермолитической ладонно-подошвенной кератодермии, курчавости волос и аритмогенной кардиомиопатии правого желудочка.
Десмоплакин (DESP) — крупный белок десмосом, относящийся к семейству плакинов, содержит 17 повторов плектина и 2 повтора спектрина. NH3-Домен служит для закрепления в цитоплазматической пластинке и связывается с NH3-доменом плакофилина 1. COOH-Домен взаимодействует с промежуточными филаментами, обеспечивая их закрепление в цитоплазматической пластинке. Десмоплакин участвует также в организации комплекса кадгерин–плакоглобин. Дефекты десмоплакина являются причиной keratosis palmoplantaris striata II(ppks2) (полосчатая ладонно-подошвенная кератодермия II), а также синдрома Carvajal (кератодермия, расширенная кардиомиопатия левого желудочка, курчавые волосы). Дефекты десмоплакина — причина семейной аритмогенной дисплазии правого желудочка, характеризующейся частичной дегенерацией миокарда правого желудочка, его электрической нестабильностью и внезапной смертью.
Десмоглеины (DSG1–DSG4) — Ca2+-связывающие гликопротеины семейства кадгеринов, участвуют во взаимодействии белков цитоплазматической пластинки с промежуточными филаментами.
Десмоглеин 1 (DSG1). Дефект DSG1 — причина полосчатой ладонно-подошвенной кератодермии I (ppks1), аутосомно-доминантного заболевания, характеризующегося утолщением кожи на ладонях и подошвах, продольными гиперкератозными поражениями кожи ладоней, удлинением всех пальцев.
Десмоглеин 3 (130 кД pemphigus vulgaris антиген) (DSG3) — аутоантиген аутоиммунного потенциально летального заболевания кожи pemphigus vulgaris (пузырчатки обыкновенной), при котором происходит генерализованное высыпание пузырей и образование обширных эрозированных поверхностей вследствие разрушения межклеточной адгезионных контактов аутоантителами против десмоглеина 3.
Десмоколлины (DSC1–DSC4) — Ca2+-связывающие гликопротеины, относящиеся, наряду с десмоглеинами, к надсемейству кадгеринов; участвуют в формировании десмосом.
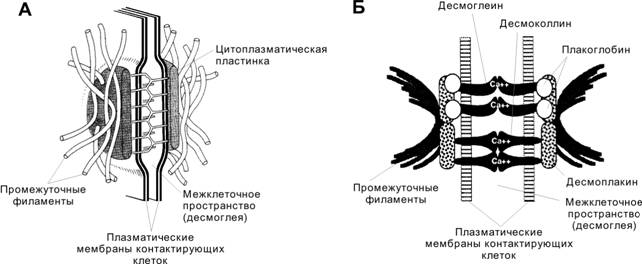
Рис. 4-8. Десмосома: строение (А) и организация (Б).Плазматические мембраны клеток разделены промежутком 20–30 нм, в котором находятся внемембранные части Ca2+-связывающих белков десмоглеина и десмоколлина. К внутренней (цитоплазматической) поверхности плазматической мембраны прилегает цитоплазматическая пластинка с вплетёнными в неё промежуточными филаментами. В состав этой пластинки входят десмоплакины, плакоглобин и часть молекулы десмоглеина. [17]
Цепь молекулярных взаимодействий (рис. 4-8). Молекулы образуют две линии связи: (1) плакоглобин (цитоплазматическая пластинка) — десмоглеин (Ca2+-связывающий белок в плазматической мембране одной клетки) — десмоглеин (Ca2+-связывающий белок в плазматической мембране другой клетки) — плакоглобин (цитоплазматическая пластинка); (2) десмоплакины (цитоплазматическая пластинка) — десмоколлин (Ca2+-связывающий белок в плазматической мембране одной клетки) — десмоколлин (Ca2+-связывающий белок в плазматической мембране другой клетки) — десмоплакины (цитоплазматическая пластинка).
Функция. Десмосомы поддерживают структурную целостность ткани, скрепляя клетки между собой. Десмосомы в комплексе с промежуточными филаментами придают ткани упругость и поддерживают в ней усилие натяжения.
Примеры. Десмосомы скрепляют клетки одного типа (кератиноциты, кардиомиоциты) и различных типов (тактильная клетка Меркеля–кератиноцит).
Дата добавления: 2015-07-07; просмотров: 3553;
