ЛЕКЦИЯ 21
ПЛАН:
1. Потенциометрическое титрование и его преимущества. Кривые титрования. Способы определения КТТ. Дифференциальные кривые титрования, их сущность для различных случаев потенциометрического титрования.
2. Методы кислотно-основного титрования. Кривые титрования.
3. Методы окислительно-восстановительного титрования. Кривые титрования.
4. Титрование с применением реакции осаждения и комплексообразования. Кривые титрования.
5. Определение веществ в растворе при их совместном присутствии.
6. Аппаратура для потенциометрического анализа. Компенсационный и некомпенсационный методы измерения ЭДС системы. Принципиальная схема потенциометра.
1.
| т.э. |

|
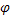 (ЭДС)
(ЭДС)
|
В методе потенциометрического титрования устанавливают зависимость разности потенциалов индикаторного электрода и электрода сравнения от объема, добавленного титранта. Зависимость обычно выражают графически:
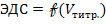
Потенциометрическое фиксирование конечной точки титрования дает более точные данные, чем соответствующий индикаторный метод. Этот метод удобнее при титровании окрашенных и непрозрачных растворов или для обнаружения в растворе веществ, о существовании которых не предполагали. Но метод более трудоемок, чем титрование с индикатором. КТТ можно определить графическим путем, найдя середину скачка и теоретическим путем по формуле:
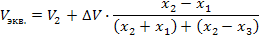
|
| V |
| т.э. |
| V |
| Е |
.
2.
Кислотно-основное титрование - быстрый и точный метод определения веществ, обладающих кислотными и основными свойствами.
Этим способом определяют неорганические и сотни органических соединений, которые часто титруют в неводных растворах. КТТ фиксируют рН метрически. В точке эквивалентности рН=7 только при титровании сильной кислоты сильным основанием и наоборот. Обычно в т.э. рН≠7.
Процесс титрования лучше всего контролировать путем измерения рН в различные моменты титрования и построения кривой титрования. Вблизи т.э. происходит резкий скачок рН.
В качестве индикаторного электрода обычно применяют стеклянный электрод или ХГ.
В качестве электрода сравнения используют каломельный электрод или хлорсеребряный.
Титрование сильной кислоты сильным основанием и наоборот:
основная реакция H+ + OH- → H2O
Дата добавления: 2015-08-04; просмотров: 1358;
