ЛЕКЦИЯ 22. 1. Теоретические основы электролиза.
ПЛАН:
1. Теоретические основы электролиза.
1.1. Электролиз и законы Фарадея.
1.2. Выход по току.
1.3. Практическое применение электролиза.
2. Электрогравиметрический анализ. Сущность метода и область применения.
3. Явление поляризации. ЭДС поляризации. Химическая поляризация. Концентрационная поляризация.
4. Напряжение разложения. Потенциал выделения. Потенциал разряда. Зависимость его от факторов перенапряжения. Перенапряжение водорода, значение этого явления. Теория перенапряжения Фрумкина.
1.
Электролиз – это окислительно-восстановительный процесс, связанный с разложение вещества под действием постоянного электрического тока.
Основные законы электролиза – это законы Фарадея, установленные им в 30 гг. прошлого века.
Существует два закона Фарадея:
Первый закон Фарадея: Масса вещества, восстановленного на катоде или окисленного на аноде, пропорциональна количеству электричества, прошедшего через раствор или расплав.
Второй закон Фарадея: Одно и то же количество электричества восстанавливает или окисляет на электродах массы различных веществ, прямо пропорциональные их химическим эквивалентам.
Оба закона можно выразить формулой:
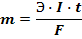
m – масса окисленного или восстановленного вещества 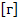
Э – электрохимический эквивалент
F – постоянная Фарадея = 96500 Кл/моль – количество электричества, расходуемое на выделение одного эквивалента.
I – сила тока 
t – время 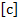
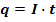 - количество электричества
- количество электричества
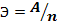
A – атомная масса элемента
n – валентность металла
Законы Фарадея соблюдаются во всех случаях и при любых условиях ведения электролиза. Если вещество выделяется в количестве меньшем, чем – то которое может быть найдено по расчету, это может означать, что затрачиваемое количество электричества используется непроизводительно, то есть на ряду с выделением данного вещества имеет место побочный процесс.
Для оценки эффективности использования электричества, на выделение того продукта ради получения которого ведется электролиз, применяют понятие выход по току:
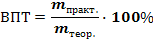
Химические процессы при электролизе:
При электролизе вещество разлагается под действием постоянного электрического тока.
Пример: электролиз CuCl2 на интерном платиновом электроде, рН = 7.
А (+) 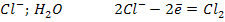
К (-) 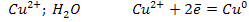
| CuCl2 |
| К (-) |
| А (+) |
| Pt |
| Pt |
Суммарное у-ние:
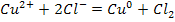
Процессы на катоде:
1. На катоде будет разряжаться катион металла в том случае, если его стандартный электродный потенциал значительно больше, чем у водорода. Такие металлы находятся в ряду напряжения после водорода.
Если стандартный электродный потенциал более отрицательный чем у водорода, то в этом случае выделяется водород.
Для pH = 7 или pH > 7: 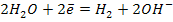
Для кислых растворов: 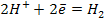
2. Если металл стоит в ряду напряжения от водорода до марганца включительно, то разряжается и металл и водород.Если выше марганца, то он вообще не разряжается из растворов.
3. Если водный раствор содержит смесь катионов металлов, то при электролизе выделение их на катоде происходит в порядке возрастания их отрицательных или убыли положительных стандартных потенциалов.
Так из смеси: 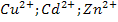 , выделяются сначала катионы меди (
, выделяются сначала катионы меди ( 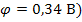 , затем кадмия (
, затем кадмия (  , и последним цинка (
, и последним цинка ( 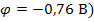 .
.
Значение потенциала выделения металла изменяется с его концентрацией: увеличение концентрации облегчает разряд, уменьшение – затрудняет.
Процессы на аноде:
1. Если анод выполнен из растворимого металла, то растворяется сам анод.
2. Если раствор содержит анионы без кислородных кислот ( 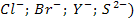 , то разряжается сам кислотный остаток.
, то разряжается сам кислотный остаток.
3. Если раствор содержит анионы кислородных кислот ( 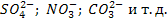 ), то на аноде окисляются молекулы воды.
), то на аноде окисляются молекулы воды.
В нейтральной и кислой среде: 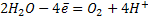
В щелочной среде: 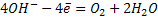
Примеры:
Электролиз раствора CuSO4; pH>7
К (-) 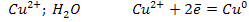
А (+) 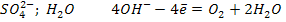
Суммарное у-ние: 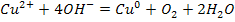
Электролиз раствора Zn(NO3)2; pH<7
К (-) 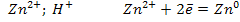

А (+) 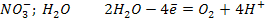
Электролиз раствора NaCl, pH=7
К (-) 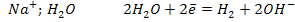
А (+) 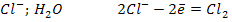
Суммарное у-ние: 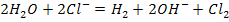
Практическое применение:
Ø для анализа
Ø для защиты от коррозии промышленных конструкций
Ø изготовление бытовой и промышленной продукции
2.
Дата добавления: 2015-08-04; просмотров: 3414;
