СТЕКЛЯННЫЙ ЭЛЕКТРОД
| Ag |
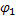
|
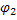
|
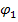 и
и 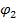 связано с ионообменным взаимодействием ионов водорода и щелочных металлов, находящихся в стекле.
связано с ионообменным взаимодействием ионов водорода и щелочных металлов, находящихся в стекле.
R-SiONa + H+ = R-SiOH + Na+
стекло р-р стекло р-р
Ионный обмен происходит только при участии гидритированной мембраны. Сухой стеклянный электрод теряет свою активность. Во внутреннем слое в результате ионного обмена устанавливается потенциал 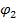 , величина которого постоянна, т.к. концентрация Н+ постоянна. Во внешнем слое устанавливается потенциал
, величина которого постоянна, т.к. концентрация Н+ постоянна. Во внешнем слое устанавливается потенциал 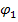 , величина которого меняется с изменением концентрации исследуемого раствора. Работает стеклянный электрод обычно в паре с каломельным электродом. Гальваническую пару можно записать следующим образом:
, величина которого меняется с изменением концентрации исследуемого раствора. Работает стеклянный электрод обычно в паре с каломельным электродом. Гальваническую пару можно записать следующим образом:
| И.К.Э. | Внешний анализируемый раствор | Стеклянная мембрана (шарик) | Внутренний раствор | Стеклянный электрод Ag│AgCl |
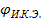
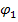
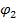
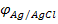
Потенциалы 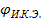 и
и 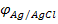 не зависят от изменения рН анализируемого раствора.
не зависят от изменения рН анализируемого раствора.
Изменение рН определяется только разностью 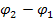 , а так как s New Roman" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:sz w:val="24"/><w:sz-cs w:val="24"/><w:lang w:val="EN-US"/></w:rPr><m:t>const</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">
, а так как s New Roman" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:sz w:val="24"/><w:sz-cs w:val="24"/><w:lang w:val="EN-US"/></w:rPr><m:t>const</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 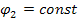 , то изменение рН определяется изменением
, то изменение рН определяется изменением 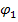 , то есть чувствительностью внешней мембраны.
, то есть чувствительностью внешней мембраны.
В схеме два электрода сравнения – внешний и внутренний – это обеспечивает возможность замера 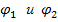 .
.
Недостатки:
Ø Высокое омическое сопротивление
Ø Потенциал асимметрии. Если концентрация ионов водорода одинакова внутри и снаружи, то на внутренней и внешней поверхностях электрода возникают разные потенциалы, что является результатом строения и природы стеклянной мембраны.
Уменьшают этот потенциал путем подбора стекла (тонкое и легкоплавкое) и периодическим вымачиванием его в буферном растворе с рН внутреннего раствора.
Преимущества:
Ø На него не действуют окислители и восстановители
Ø Область применения рН=0-14, то есть кислые и щелочные среды
5.
Определение рН растворов с помощью индикаторных электродов:
1) Два водородных электрода
(-) Рt(Н2) │2Н+ ∫исследуемый раствор∫ 2Н+│(Н2)Рt (+)
индикаторный стандартный
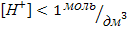
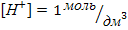
Р = 1атм. t = 25 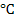
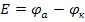
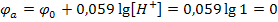
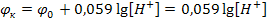

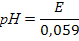
2) Каломельный электрод - хингидронный электрод
(-) Нg│Нg2Cl2│КС1 ∫ исследуемый раствор ∫ ХГ (+)
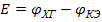
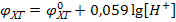
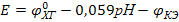
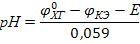
3) Стеклянный электрод - каломельный электрод
(-) стандартный ∫станд. р-р или ∫ КСl│каломельный (+)
электрод иссл. р-р насыщ. электрод
Прибор градуируется в единицах рН.
Дата добавления: 2015-08-04; просмотров: 2703;
