ЛЕКЦИЯ 19
ПЛАН:
1. Сущность метода и область применения. Классификация: ионометрия (прямая потенциометрия), потенциометрическое титрование.
2. Электроды. Электроды первого и второго рода.
3. Электроды сравнения. Требования, предъявляемые к электродам сравнения. Водородный нуль - электрод, каломельный, хлорсеребряный электроды.
4. Индикаторные электроды. Электроды, применяемые в кислотно-основном методе. Устройство водородного, хингидронного, стеклянного электродов. Преимущества и недостатки этих электродов.
5. Определение рН растворов с помощью цепей, состоящих из двух водородных электродов, хингидронного и каломельного электродов, стеклянного и каломельного электродов.
1.
Потенциометрический метод анализа основан на изменении величины потенциала электрода в зависимости от физических или физико-химических процессов, протекающих в системе.
При погружении металлической пластины в раствор на границе металл - раствор возникает электродный потенциал. 
| Zn2+ |
| Zn |
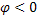
|
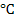
Величина и знак заряда зависят от энергии решетки металла при данной концентрации ионов в растворе.
Если энергия гидратации велика, происходит образование катионов, металл заряжается отрицательно за счет избытка электронов. Электростатическое поле притягивает к себе катионы из раствора. Возникает двойной электрический слой. Нейтрализации ионов не происходит, т.к. ионы удерживаются молекулами воды. Внутри двойного электрического слоя создается некоторая разность потенциалов.
Величина и знак потенциала зависят от:
Ø природы металла
Ø растворителя
Ø концентрации ионов в растворе
и выражается уравнением Нернста:
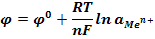
| Cu2+ |
| Cu |
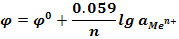
Энергия гидратации мала, медь оседает на пластинке, потенциал 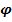 >0.
>0.
Металлические пластинки бывают двух типов:
1) Металл - проводник, находящийся в контакте с раствором
своих ионов.

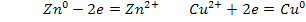
2) Инертный металл (Рt), находящийся в контакте с раствором ионов, составляющих окислительно-восстановительную пару.
Например:платиновая проволока, опущенная в раствор с Fе2+ и Fе 3+.
При этом на электроде протекает полуреакция восстановления: Fe3+ + e = Fe2+
и полуреакция окисления: Fe2+ - e = Fe3+.
Мерой окислительно-восстановительной способности служит электродный редокспотенциал:
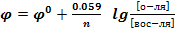
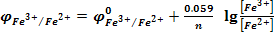
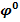 - стандартный электродный потенциал – это потенциал, замеренный относительно водородного электрода при t=25
- стандартный электродный потенциал – это потенциал, замеренный относительно водородного электрода при t=25 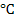 и концентрации определяемого иона = 1 моль/дм3.
и концентрации определяемого иона = 1 моль/дм3.
Измерить потенциал одного электрода нельзя, но можно измерить ЭДС гальванического элемента, составленного из двух электродов, потенциал одного из которых есть величина постоянная, а потенциал второго меняется с изменением концентрации определяемого иона в растворе (такой электрод выступает в роли индикатора).
Если 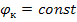 , то
, то 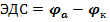 будет зависеть только от потенциала анода, который является индикатором.
будет зависеть только от потенциала анода, который является индикатором.
Электрод, потенциал которого изменяется с изменением концентрации определяемого иона, называется индикаторным электродом.
Электрод, потенциал которого остается постоянным, называется стандартным электродом или электродом сравнения.
Потенциометрический метод анализа применяется:
· для нахождения точки эквивалентности в титриметрии
· для определения концентрации ионов в растворе
· для изучения химических реакций
Потенциометрический метод анализа делится на прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия - определяет значение электродного потенциала, и вычисляют по уравнению Нернста концентрацию определяемого иона.
Потенциометрическое титрование - конец реакции определяют по резкому изменению электродного потенциала в эквивалентной точке индикатор - электрод.
2.
Все электроды можно разделить на электроды I и II рода.
Электроды I рода – это, электроды, обратимые относительно катионов, т.е. чувствительны к тем катионам, с которыми они могут образовывать окислительно-восстановительную систему.
Например: Аg(электрод) │ АgNO3 (раствор)
Аg + е = Аg(тв)
Такой электрод чувствителен только к катионам серебра.
К электродам первого рода можно отнести и водородный электрод. Газообразный водород, адсорбированный на металле, образует с ионами водорода в растворе окислительно-восстановительную систему: 2Н++2е = Н2 .
Электроды, чувствительные к анионам, которые образуют малорастворимые осадки с катионами металла электрода, относятся к электродам второго рода. Электроды второго рода чувствительны также к изменению концентрации ионов, которые не участвуют непосредственно в окислительно -восстановительном процессе.
Например: Аg│АgСl (насыщенный раствор)
АgСl(тв) + е = Аg(тв) + Сl-
Потенциал электрода зависит от концентрации Сl-, т.к. раствор АgСl насыщенный ПР=[Аg+][Сl-], отсюда [Аg+]=ПР/[Сl-].
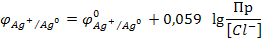
Можно определить как концентрацию Сl- и Аg+ - ионов.
К электродам второго рода относятся хлорсеребряный и каломельный электроды.
3.
Электроды сравнения могут быть электроды второго рода при условии сохранения условия постоянной концентрации ионов, определяющих электродный процесс.
Например: Hg│Нg2Сl2│КСl - каломельный;
Нg│Нg2SO4│Н2SO4 - сульфатнортутный;
Аg│АgСl│КСl - хлорсеребряный.
Требования к электродам сравнения:
Ø
| H2SO4 |
| Pt |
| в иссл. раствор |
| H2 |
| рис 3 |
| рис 2 |
| рис 1 |
| пробка из агар-агира |
| паста |
| H2 |
| Hg |
| KCl р-р |
потенциал должен быть постоянен во времени и по температуре
Ø
| Ag |
ВОДОРОДНЫЙ ЭЛЕКТРОД (рис 1)
Платину покрывают чернью для лучшей воспроизводимости опытов и для уменьшения влияния загрязнений.


Водород должен быть абсолютно чистым (обычно получают электролитическим путем). Потенциал такого электрода условно принят равным нулю. 
ХЛОРСЕРЕБРЯННЫЙ ЭЛЕКТРОД (РИС 2)
Серебряный электрод, погруженный в раствор хлорида калия, насыщенный хлоридом серебра.
1. пористая пробка (через пробку идет контакт с исследуемым раствором)
2. пробка из агар - агара
3. твердый КСl
4. раствор насыщенный КСl + 1 капля 1М АgNO3
5. серебряная проволочка
Иногда электрод изготавливают проще: серебряную проволоку окунают в расплав АgСl, который хорошо проводит электрический ток, а затем погружают в раствор КСl.
Аg│АgСl│КС1 (АgСlтв + е = Аg++Сl-)
Постоянство электродного потенциала поддерживается избытком хлорида калия, а именно избытком Сl-, который входит в состав АgСl, малорастворимой соли.
Преимущества: прост и удобен в работе.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД (РИС З)
Нg│Нg2Сl2│КСl Нg2Cl2 + 2е = 2Нg+ + 2Сl-
Потенциал каломельного электрода зависит от концентрации хлорид ионов, она должна быть фиксированной для каждого электрода.
Электроды различают по концентрации КСl: насыщенные, 1Н; 0,1Н.
Недостаток: имеет высокое сопротивление, легко поляризуется.
4.
Индикаторный электрод - это электрод, изменяющий свой потенциал с изменением концентрации определяемого иона.
Индикаторный электрод выбирают в зависимости от типа реакции.
Требования к индикаторному электроду:
Ø обратимость электрода
Ø потенциал устанавливается мгновенно
Ø не должен реагировать на примеси
Метод нейтрализации: в основе метода лежит реакция
H+ + ОН-=Н2O. Индикаторный электрод должен реагировать на изменение концентрации ионов водорода.
Дата добавления: 2015-08-04; просмотров: 4130;
