Химические свойства. Главным структурным элементом, определяющим химические свойства олефинов, является двойная связь, включающая одну σ- и одну π-связь
Главным структурным элементом, определяющим химические свойства олефинов, является двойная связь, включающая одну σ- и одну π-связь. Атомы углерода двойной связи пребывают в состоянии sp2-гибридизации. Сравнение статических факторов, в частности длины и энергии связи показывает, что двойная связь короче и прочнее ординарной связи:
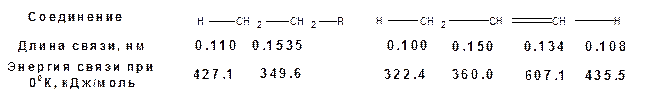
Энергия двойной связи 607.1 кДж/моль, что больше энергии ординарной связи – 349,6 кДж/моль. Однако две ординарные связи по энергии превосходят одну двойную связь на 92.1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
Из этого следует, что для олефинов наиболее характерны реакции присоединения. Но некоторым видам олефинов свойственны реакции замещения. Наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи. Так назыываемое аллильное положение. Образующийся, при гомолитическом разрыве связи радикал способен взаимодействовать с электронами π-связи, что обеспечивает его высокую стабильность и соответственно высокую реакционную способность.
Поскольку π-связь представляет собой облако отрицательного заряда расположенное над и под плоскостью молекулы, то олефины должны быть склонны к взаимодействию с частицами, несущими положительный заряд. Реагентами, несущими положительный заряд являются электрофилы.
5.1. Электрофильное присоединение
Электрофильным присоединением (АdЕ) называют реакции присоединения, в которых в скоростьлимитирующей стадии атакующей частицей является электрофил.
Механизм электрофильного присоединения включает три стадии.
Например, присоединение бромистого водорода к этилену с образованием бромистого этила в среде четыреххлористого углерода:
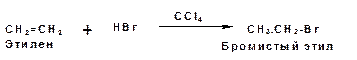
Механизм:
1. На первой стадии образуется так называемый π-комплекс:
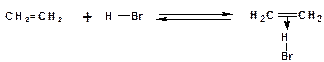
Особенностью π-комплекса является то, что атомы углерода двойной связи находятся в состоянии sp2-гибридизации.
2. Образование промежуточного карбкатиона. Эта стадия является медленной (скоростьлимитирующей):
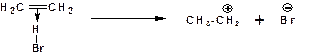
На этой стадии один из атомов углерода двойной связи переходит в состояние sp3-гибридизации. Другой остается в состоянии sp2-гибридизации и приобретает вакантную р-орбиталь.
3. На третьей стадии бромид-ион, образовавшийся на второй стадии, быстро присоединяется к карбкатиону:

Аналогичный механизм можно привести для реакции электрофильного присоединения брома к этилену с образованием 1,2-дибромэтана в среде четыреххлористого углерода.
1. Образование π-комплекса:
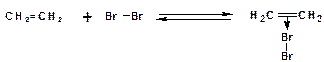
2. Образование циклического бромониевого иона:
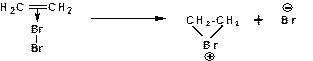
Циклический бромониевый ион более стабилен, чем открытый этил-катион. Причина такой стабильности в том, что в циклическом бромониевом ионе все атомы имеют по восемь электронов на внешнем электронном уровне. В то время как в этил-катионе у атома углерода, несущего положительный заряд имеется только шесть электронов. Образование бромониевого иона связано с гетеролитическим разрывом связи Br- Br и отщеплением бромид-иона.
3. Присоединение бромид-иона к циклическому бромониевому иону:
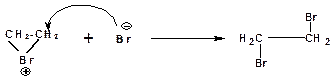
Поскольку одна сторона исходного алкена экранирована в бромониевом ионе положительно заряженным атомом брома, то бромид-ион может атаковать бромониевый ион только с противоположной стороны. При этом трехчленный цикл раскрывается, а бромид-ион образует ковалентную связь с атомом углерода. Продуктом присоединения является вицинальный дибромид.
Доказательством представленного механизма, предусматривающего атаку бромониевого иона бромид-ионом с тыльной стороны, является образование транс-1,2-дибромциклогексана по реакции циклогексена с бромом:
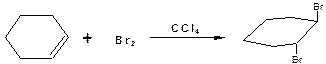
Правило Марковникова.
Взаимодействие галогенводородов с несимметричными алкенам по механизму электрофильного присоединения приводит к образованию продуктов строго определенного строения. Так по реакции 2-метил-2-бутена с бромистым водородом преимущественно образуется 2-бром-2-метилбутан:
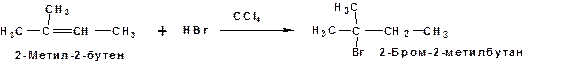
Строение, образующегося продукта в случае реакции электрофильного присоединения к несимметричным алкенам подчиняется правилу Марковникова:
При присоединении галогеноводорода к несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному (имеющему большее число атомов водорода) атому углерода (1869г.).
Объяснение данному направлению хода реакции заключается в том, что образующиеся на второй стадии механизма электрофильного присоединения карбкатионы формируют ряд стабильности, аналогичный ряду стабильности радикалов:
Метил-катион <первичный <вторичный <третичный.
В соответствии с рядом стабильности продукт присоединения галогенид-иона к третичному углеродному атому будет более предпочтительным, чем присоединение ко вторичному.
По механизму электрофильного присоединения в соответствии с правилом Марковникова к олефинам присоединяются:
галогенводороды; галогены, вода, гипогалогенитные кислоты:
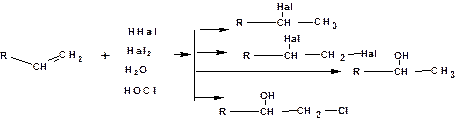
В случае присоединения гипогалогенитных кислот в роли электрофильной частицы выступает ион галоида (кроме фтора), поскольку электроотрицательность хлора, брома и йода меньше, чем у кислорода.
Дата добавления: 2015-08-01; просмотров: 910;
