Факторы, определяющие реакционную способность
Факторы, определяюще реакционную способность делятся на две группы: статические и динамические.
Статические
1. Энергия связей. По энергии связи С-Н различаются в зависимости от того с каким атом углерода соединен атом водорода. Например, по своей энергии связи С-Н формируют следующий ряд:
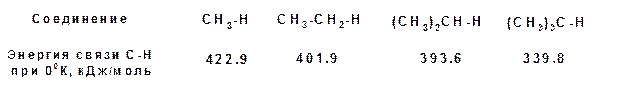
2. Доступность связей или еще называют стерический (пространственный фактор). Расщепление молекулы алкана по σ-связи С-С требует 350 кДж/моль. Расщепление -связи С-Н требует 340 - 420 кДж/моль. Т.е. связь углерод-углерод является менее прочной и, казалось бы, реакции должны предпочтительно идти по связи С-С. Однако реакции чаще идут с расщеплением связей С-Н, поскольку эти связи находятся на периферии молекулы и более доступны атаке реагентами.
Энергия химической связи и стерический фактор относятся к разряду так называемых статических факторов, определяющих реакционную способность. На ряду со статическими - действуют динамические факторы. В частности в приложении к алканам действует фактор стабильности свободных радикалов.
Динамические
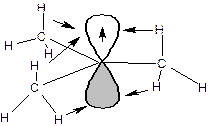
Определение:Свободными радикалами называются частицы, имеющие один или несколько неспаренных электронов. Наибольшее значение в органической химии имеют свободные радикалы с неспаренным электроном на атоме углерода. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а, следовательно, имеет плоскостное строение:

Если радикалы R1, R2 и R3 являются алкильными радикалами, то возможно взаимодействие (перекрывание) орбитали, на которой находится неспаренный электрон, со связями С-Н:
Такое взаимодействие называется сверхсопряжением или гиперконьюгацией. За счет сверхсопряжения неспаренный электрон получает приток электронной плотности с противоположным спином, что способствует его стабилизации. Из этой схемы следует, что чем больше алкильных заместителей у атома, несущего неспаренный электрон, тем более устойчивым является радикал. Соответственно радикалы формируют следующий ряд стабильности:
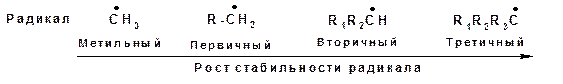
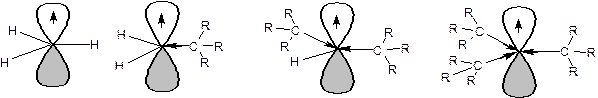
Ряд стабильности радикалов может иметь другое объяснение. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а алкильные радикалы построены из атомов углерода в состоянии sp3-гибридизации. Поэтому атом углерода, несущий неспаренный электрон является более электроотрицательным, чем атомы углерода заместителей. Соответственно происходит смещение электронной плотности по системе σ-связей к атому, несущему неспаренный электрон. Чем больше будет заместителей, тем больше электронной плотности будет смещено к радикалу, тем выше его стабильность:
Совокупность статических и динамических факторов определяет характер и направление протекания реакций. В том числе реакций радикального замещения у насыщенного атома углерода. Реакции радикального замещения обозначаются символом SR.
Примеры реакций.
Дата добавления: 2015-08-01; просмотров: 842;
