Законы Фарадея. Количественные расчеты при электролизе.
Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
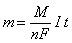 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина 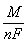 называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8 Ач/моль.
называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8 Ач/моль.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току: 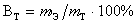 .
.
Дата добавления: 2015-07-30; просмотров: 1653;
