Электролиз растворов
Водные растворы электролитов сильно усложняют анализ электрохимических процессов при электролизе, поскольку вода хоть и слабый, но все таки электролит, в котором в малом количестве присутствуют ионы водорода (Н+ ) и гидроксильных групп (ОН- ).
На рис. 9.5.1 показана схема электролитической ячейки, в которой происходят процессы при электролизе раствора хлорида натрия.
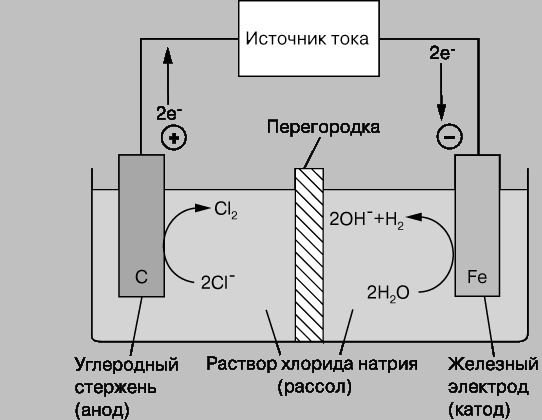
Рис. 9.5.1. Схема электролитической ячейки, для электролиза раствора NaCl, анод - графит, катод – железо.
Простая запись схемы электролиза будет такой:
А(+) С | NaCl, H2O | Fe К(-),
при этом, в отличие от ГЭ, на анод подается положительный заряд источника тока, на катод – отрицательный. На аноде будет протекать процесс окисления ионов хлора с образованием молекулярного хлора, на катоде происходить разложение молекул воды с выделением молекулярного водорода и образованием гидроксид-ионов. Суммарный процесс на электродах при электролизе запишем так:
2Cl- + 2H2O = Cl2 + H2 + OH-
В процессе проведения электролиза очень важно подбирать такие условия, при которых обеспечивается наиболее оптимальный результат достижения требуемых параметров, что возможно при расчетах с применением законов Фарадея.
Дата добавления: 2015-07-30; просмотров: 1996;
