Глава 2. Температура. I закон термодинамики.
Глава 1. Основные понятия.
1.1 Система.
Тело или группа тел, произвольно выделяемая нами из внешнего мира, называется системой. Все, что не входит в нашу систему, мы называем внешней средой или просто средой.
Системой может быть что угодно: мономолекулярная пленка на поверхности жидкости, стенка мыльного пузыря, газ в объеме, раствор, твердое тело, система электрических зарядов, расплавы солей и металлов, ректификационная колонна, плазма.
Изолированной или замкнутой системой называется такая система, которая не может обмениваться со средой веществом и энергией.
Система называется адиабатической, если она не обменивается теплом с окружающей средой (адиабарос – греческое – непереходимый).
Система называется закрытой, если она не обменивается со средой веществом. Однако закрытая система может изменять свой состав, если в ней протекает химическая реакция, которую символически можно записать в виде
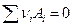
где 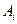 -некоторое химическое соединение,
-некоторое химическое соединение, 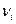 - стехиометрический коэффициент, причем для исходных веществ
- стехиометрический коэффициент, причем для исходных веществ 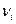 берется со знаком «минус», для продуктов реакции со знаком «плюс», например
берется со знаком «минус», для продуктов реакции со знаком «плюс», например
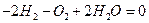
Это уравнение показывает, что в системе число молей водорода уменьшилось на 2, кислорода на 1, а число молей воды увеличилось на 2.
1.2 Параметры.
Все признаки, характеризующие систему и ее отношение к среде,называются параметрами системы. Объем, показатель преломления, удельный вес, заряд, давление.
Термодинамическими параметрами называется объем, давление, температура, энергия, концентрация веществ и производные только от этих (теплоемкость, коэффициент расширения и т.д.).
Все параметры делятся на два класса – внутренние и внешние.
Параметры, определяемые положением не входящих в нашу систему внешних тел, называются внешними параметрами. Объем системы, величина поверхности определяются расположением внешних тел. Напряжение силового поля зависит от положения источников поля – зарядов и токов, не входящих в систему (и масс – поле тяготения).
Параметры называются внутренними, если они определяются совокупным движением и распределением в пространстве тел и частиц, входящих в нашу систему. Плотность, давление, энергия – внутренние параметры. Естественно, что величины внутренних параметров зависят от внешних параметров.
Кроме того параметры можно разделить и по другому признаку. Назовем интенсивными параметрами такие, которые не зависят от количества вещества в системе, например, давление, температура, коэффициент теплопроводности и т.п.. Параметры, которые зависят от количества вещества в системе, назовем экстенсивными, к таковым относятся объем, энергия, энтропия и т.д.
Следует заметить, что отнесенные к единице количества вещества экстенсивные параметры приобретают свойства интенсивных, например, мольный объем, мольная энергия.
1.3 Состояние.
Этот термин обозначает данную совокупность значений параметров системы. Если изменяется хотя бы один, то изменяется и состояние. системы.
Состояние называется стационарным, если оно не меняется во времени.
Состояние называется равновесным, если в системе не только все параметры постоянны, но и нет никаких стационарных потоков за счет действия каких-либо внешних источников, т.е. неизменность не обусловлена никакими внешними процессами.
1.4 Процесс
Процессом называется ряд последовательных изменений состояния системы.
Процесс, после которого система возвращается в первоначальное состояние, называется круговым процессом или циклом.
V = Const изохорический греческое chora – пространство
p = Const изобарический греческое baros – тяжесть, вес
t = Const изотермический греческое therme – жар, теплота
Q = 0 адиабатический
1.5 Функции состояния.
Свойство системы, не зависящее от предыстории системы и полностью определяемое ее состоянием в данный момент (т.е. совокупностью параметров), называется функцией состояния. Если Z –функция состояния и в состоянии 1 имеет величину 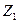 , а в состоянии 2 величину
, а в состоянии 2 величину 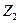 , то ее изменение при переходе системы из состояния 1 в состояние 2 очевидно равно
, то ее изменение при переходе системы из состояния 1 в состояние 2 очевидно равно
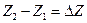
где символ Δ обозначает,что из значения функции 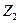 в конечном состоянии мы вычли значение функции
в конечном состоянии мы вычли значение функции 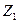 в начальном состоянии.
в начальном состоянии.
Чтобы Z имела свойства функции состояния необходимо и достаточно
либо 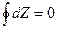 либо если
либо если 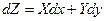 равенство перекрестных производных.
равенство перекрестных производных.
Если процесс не круговой, то
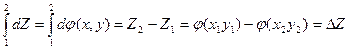
Изменение функции состояния не зависит от процесса перехода между 1 и 2
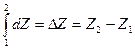
 dZ = Xdx + Ydy
dZ = Xdx + Ydy 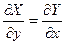
обратное справедливо.
Иными словами бесконечно малое изменение функции состояния dZ обладает свойствами полного дифференциала.
1.6. Уравнение состояния
Изменение одного из свойств системы вызывает изменение по крайней мере еще одного свойства, т.е. имеется функциональная зависимость термодинамических параметров, которая носит название уравнения состояния.
Уравнение φ(p,v,T) = 0 является уравнением состояния чистого вещества, если 1) отсутствуют электрические и магнитные поля,
2) эн. гравитации и поверхности можно пренебречь,
3) v – раномерно заполнен объем,
4) во всех частях системы давление и температура постоянны.
pV = nRT – частный случай.
Уравнение состояния различных систем термодинамика берет в готовом виде.
Глава 2. Температура. I закон термодинамики.
2.1. Температура.
Введем следующие два постулата:
1) изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно из него выйти не может;
2) если две системы порознь находятся в равновесии с третьей, то они находятся и в равновесии между собой.
Возьмем две равновесные изолированные системы и дадим им возможность взаимодействовать друг с другом путем теплообмена. Очевидно возможны два варианта: либо равновесное состояние обеих систем не нарушится, либо нарушится, но стечением времени эта двойная система (в целом изолированная) придет в новое состояние равновесия (постулат 1). Отсюда можно сделать вывод, что существует некоторый параметр, который может указать нарушается ли равновесное состояние систем при тепловом контакте друг с другом или нет. Этот параметр называется температурой.
Итак: любая термодинамическая система обладает функцией состояния – температурой. Равенство температур во всех точках есть условие теплового равновесия двух систем или двух частей одной и той же системы.
Очевидно, во-первых, чтобы узнать одинаковы ли температуры двух систем совершенно необязательно их приводить в тепловой контакт друг с другом, можно, согласно постулату 2, их привести в тепловой контакт с некоей третьей системой, которую мы обычно называем термометром.
Во-вторых, мы совершенно условно принимаем, что температура той системы выше, которая при тепловом контакте уменьшает свою энергию.
В-третьих, единицей измерения температуры является кельвин, который обозначается буквой К. Международным соглашением приняты следующие величины температур основных и вспомогательных реперных точек:
МПТШ – 68 (ред. 1975 г.)
Ратм Т,К t 0C
Н2 тройная точка 6,939·10-2 13,81 -259,34
Дата добавления: 2015-07-30; просмотров: 1130;
