Для облегчения расчетов следует поступать так
если p=Const
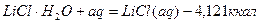
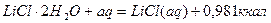
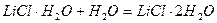
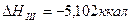
Уравнения химических реакций вместе с тепловыми эффектами называются термохимическими уравнениями и с ними можно оперировать как с алгебраическими уравнениями. Запомним, что если
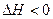 Qp выделяется
Qp выделяется
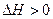 Qp поглощается
Qp поглощается
3.4. Связь между Qp и QV
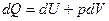
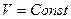
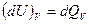
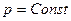
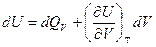
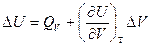
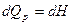
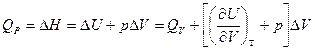
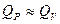 если реагенты только жидкие или твердые вещества
если реагенты только жидкие или твердые вещества 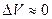
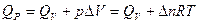 , где Δn –изменение числа молей газообразных участников реакции
, где Δn –изменение числа молей газообразных участников реакции
CO + H2O = CO2 + H2 Δn = 0 Qp = Qv
N2 + 3H2 = 2NH3 Δn = -2 Qp < Qv
Zn (тв) + H2SO4 (ж) = ZnSO4 (p-p) + H2 (газ) Δn = +1 Qp > Qv
Но для реакции в конденсированной системе:
CuSO4 + 5H2O (ж) = CuSO4 5H2O (кр)
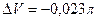
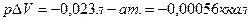 , т.е. разница между QP и QV очень мала, ею можно пренебречь.
, т.е. разница между QP и QV очень мала, ею можно пренебречь.
3.5. Теплота образования химических соединений.
Теплотой образования химического соединения называется тепловой эффект реакции образования одного моля данного соединения из соответствующих чисел молей простых веществ.
Стандартной теплотой образования 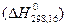 называется теплота образования химического соединения из простых веществ, находящихся в стандартных условиях, причем продукты реакции также находятся в стандартных условиях.
называется теплота образования химического соединения из простых веществ, находящихся в стандартных условиях, причем продукты реакции также находятся в стандартных условиях.
За стандартные условия приняты: температура 25 0С (298,15 К) и
1 атм (760 торр).
Замечания
1. Стандартная теплота образования простого вещества равно нулю
2. Простое вещество имеет то агрегатное состояние, в котором оно находится в стандартных условиях.
С (графит) 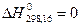
С (алмаз) 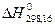 = 453,2 кал/г-ат
= 453,2 кал/г-ат
О2 (кислород) 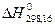 = 0 кал/моль
= 0 кал/моль
О3 (озон) 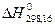 = 34,0 ккал/моль
= 34,0 ккал/моль
Исключение: для фосфора – белый фосфор
Теплоты образования химических соединений обычно вычисляются по экспериментальным теплотам соответствующих химических реакций, например, для I2O5 :
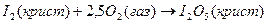
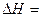 ?
?
1. 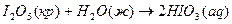
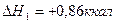
2. 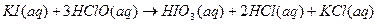
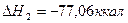
3. 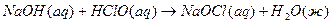
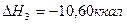
4. 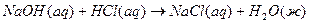
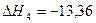
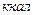
5. 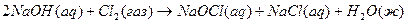
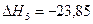
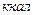
6. 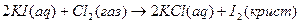
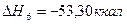
7. 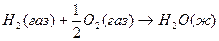
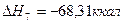
8. 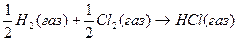
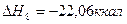
9. 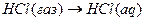
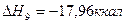
По закону Гесса : 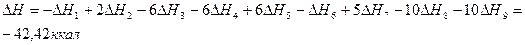
Теплоты образования химических соединений приводятся в справочниках физико-химических величин и для вычисления теплового эффекта химических реакций необходимо из суммы теплот образования продуктов реакции вычесть сумму теплот образования исходных веществ:
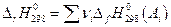
Заметим, что в дальнейшем изложении мы введем еще ряд функций состояния и для них закон Гесса также справедлив.
3.6 Зависимость теплового эффекта химической реакции от температуры.
Если Hi мольная энтальпия химического соединения, то
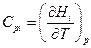
Очевидно, что для некоторой химической реакции 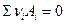
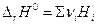
Дифференцирование по температуре, разделение переменных и интегрирование в интервале от Т1 до Т2 дают (р = const)
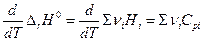
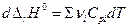
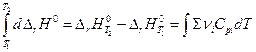
и 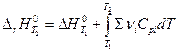 (уравнение Кирхгоффа)
(уравнение Кирхгоффа)
Аналогично для ΔU и Cv.
Дата добавления: 2015-07-30; просмотров: 979;
