Пространственное строение координационных соединений.
В зависимости от природы металла-комплексообразователя, координационного числа и типа лигандов, комплексы могут иметь различные структуры:
| Тип гибридизации | К.Ч. | Геометрия комплекса | Примеры |
| sp | линейная | [Ag(CN)2]- [Cu(NH3)2]+ | |
| sp2 | треугольная | [HgI3]- | |
| sp3 | тетраэдр | [Be(OH)4]2- [MnCl4]2- [Zn(NH3)4]2+ | |
| dsp2 | квадрат | [Ni(CN)4]2- [PtCl4]2- [Pt(NH3)2Cl2]0 | |
| sp3d(z2) | тригональная бипирамида | [Fe(CO)5] | |
| sp3d(x2-y2) | квадратная пирамида | [MnCl5]3- [Ni(CN)5]3- | |
| sp3d2, d2sp3 | октаэдр | [Al(H2O)6]3+ [SnCl6]2- [Co(NH3)6]3+ [Fe(CN)6]3- | |
| sp3d3 | пентагональная бипирамида | [V(CN)7]4- [ZrF7]3- |
Изомерия комплексных соединений.
Под изомерами обычно понимают соединения одного и того же состава, но различного строения и свойств. У комплексных соединений встречается геометрическая изомерия, ионизационная, гидратная, связевая, оптическая и другие виды изомерии.
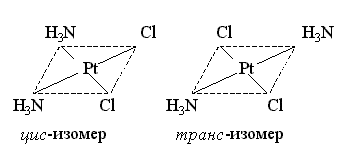
Геометрическая изомерия. Этот вид изомерии обусловлен различным пространственным расположением лигандов разнолигандных комплексов во внутренней координационной сфере:
Дата добавления: 2015-07-30; просмотров: 1028;
