Химическое равновесие в гетерогенных системах. Наиболее частые случаи гетерогенного равновесия относятся к системам, в которых содержатся одновременно твердые вещества и жидкий раствор или газовая смесь.
Наиболее частые случаи гетерогенного равновесия относятся к системам, в которых содержатся одновременно твердые вещества и жидкий раствор или газовая смесь.
Напомним, что части системы, имеющие одинаковый состав и одинаковые физические свойства, называются фазами.
Если твердые фазы состоят из чистых кристаллических веществ, то их химические потенциалы являются константами, так как термодинамическая активность чистого кристаллического вещества равна 1. Поэтому ни молярная доля, ни термодинамическая активность таких веществ в уравнения, отражающие закон действия масс, не входят.
Рассмотрим некоторые примеры.
Равновесие в системе c реакцией C(h) + CO2 (g) = 2СO (g).
Если принять, что СО2 и СО являются идеальными газами, а углерод - чистым кристаллическим веществом, то уравнение закона действия масс принимает следующий вид:
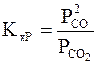 .
.
Равновесие между труднорастворимой солью и раствором, содержащим входящие в ее состав ионы.
Пусть в состав труднорастворимой соли входят ионы: Cat+y и An-x. Равновесие между труднорастворимой солью и ионами можно представить следующим образом:
CatxAny = xCat+y + yAn-x.
Соль является чистым кристаллическим веществом, термодинамическая активность которого равна 1. Закон действующих масс для данного случая выражается уравнением
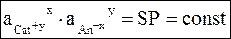 (7 - 15)
(7 - 15)
Уравнение (7 - 15) выражает известное из аналитической и неорганической химии произведение растворимостиSP.
Дата добавления: 2015-07-24; просмотров: 768;
