Соотношение между различными константами равновесия для газовых систем
Кроме приведенных выше констант равновесия КР и Кx, установленных для газовых систем, находящихся при постоянном давлении, рассмотрим константу, описывающую равновесие при постоянном объеме.
Используя уравнение состояния идеального газа в форме
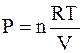 ,
,
парциальное давление в случае постоянного объема газовой фазы можно выразить через молярную концентрацию Ci:
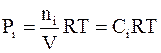 . (7 - 16)
. (7 - 16)
Подстановка правой части выражения (7 - 16) вместо парциального давления в уравнение для химического потенциала дает
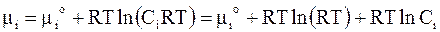 .
.
Объединив все константы, запишем уравнение для химического потенциала при постоянном объеме в традиционной форме
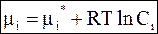 . (7 - 17)
. (7 - 17)
Подстановка выражения (7 - 17) в общее уравнение для химического равновесия приводит к еще одной форме закона действующих масс, применяемой при постоянном объеме
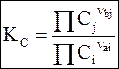 . (7 - 18)
. (7 - 18)
Константа КС называется константой равновесия при постоянном объеме.
Константы КР, Кх и КС являются основными константами равновесия для идеальных газовых смесей, в которых протекают химические реакции. Найдем соотношения, связывающие их друг с другом, для чего воспользуемся уравнением (7 - 16) и следующим выражением:
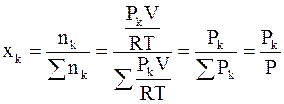 (7 - 19)
(7 - 19)
или
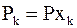 . (7 - 20)
. (7 - 20)
Подставляя в уравнение (7 - 11) вместо Pk правую часть равенства (7 - 20), получим
 . (7 - 21)
. (7 - 21)
Обозначив nbj - nai º Dn и приняв во внимание уравнение (7 - 13), получим
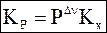 . (7 - 22)
. (7 - 22)
Подстановка правой части равенства (7 - 16) вместо Pk в уравнение (7 - 11) приводит к уравнению
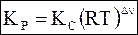 . (7 - 23)
. (7 - 23)
Уравнения (7 - 22) и (7 - 23) позволяют связать друг с другом основные константы равновесия для идеальных газов.
Дата добавления: 2015-07-24; просмотров: 1161;
