ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Периодическую систему элементов – фундаментальный закон, являющийся основой современной химии и атомной физики, - разработал в 1869-71гг. Д.И. Менделеев. Объяснить таблицу Менделеева можно на основе квантовых закономерностей заполнения электронных состояний в атоме. Распределение электронов по состояниям подчиняется двум принципам: минимуму энергии и запрету Паули.
При возрастании порядкового номера Z (зарядового числа) элемента в таблице Менделеева на единицу к электронной оболочке добавляется один электрон, причем в первую очередь заполняются разрешенные состояния с меньшей энергией. При этом электроны атома группируются в слоии оболочки.
Слоем называют совокупность квантовых состояний с фиксированным значением главного квантового числа. Для обозначения слоя используются большие латинские буквы в соответствии с таблицей 2.
Таблица 2
| Значение N | ||||||
| Обозначение слоя | K | L | М | N | О | Р |
Наибольшее число электронов, которое может входить в слой, определяется принципом Паули, то есть равно числу различных квантовых состояний Nn=2 n2.
Совокупность квантовых состояний с одинаковыми значениями квантовых чисел n и l называют оболочкой. Оболочки обозначают символами ns, nр…, где n- значение главного квантового числа, а маленькая латинская буква указывает значение орбитального числа l (см.табл.1 п. 2.6.1). Если пренебречь спин-орбитальным взаимодействием, то можно считать, что электроны из данной оболочки имеют одинаковую энергию. Они заполняют состояния с различными допустимыми значениями чисел ml и ms. В каждой оболочке имеется 2(2l+1) квантовых состояний. Согласно принципу Паули это число совпадает с максимально возможным количеством электронов оболочки.
Наибольшее число электронов в слоях и оболочках приведено в таблице 3 для пяти слоев.
Таблица 3
| Обозначение слоя | Значение n | Максимальное число электронов | |||||
| В оболочках : Nn,l = 2 (2l +1) | в слоях Nn=2n2 | ||||||
| s | p | d | F | q | |||
| K | |||||||
| L | |||||||
| M | |||||||
| N | |||||||
| O |
Для атомов с числом электронов Z£18 сначала полностью застраивается электронный слой, соответствующий меньшему значению главного квантового числа n, а внутри каждого слоя сначала заполняются оболочки с меньшим значением орбитального квантового числа l. Это объясняется тем, что в сложных атомах энергия электрона зависит не только от главного квантового числа n, но и от орбитального числа l: с ростом l растет энергия состояния. (объяснение дано в п.2.7.4).
Указанная очередность заполнения электронами слоев и оболочек в невозбужденных атомах сохраняется вплоть до аргона (Z=18). Начиная с атома калия (Z=19) существенным становится экранирующий эффект внешнего электронного слоя по от
ношению к внутренним слоям, поэтому энергия электрона увеличивается в следующем порядке:
W1s<W2s<W2p<W3s<W3p<W4s<W3d<W4p<W5s<W4d<W5p<W6s<…
Распределение электронов по отдельным слоям и оболочкам называется электронной конфигурацией атома. Например, электронная конфигурация натрия (Z=11) 1s2 2s2 2p63s1 означает, что в 1s состоянии (n=2 , l=0) – находятся два электрона, в 2s- состоянии тоже два электрона, в 2р-состоянии (n=2, l=1) – шесть электронов, а в 3s-состоянии (n=3, l=0)-лишь один электрон, то есть это состояние в атоме Nа заполнено частично.
Структура внешнего электронного слоя атома определяет химические свойства элемента. Периодическая повторяемость свойств химических элементов обусловлена периодичностью структуры электронных оболочек атомов.
Кратко рассмотрим последовательность заполнения электронами состояний в атомах некоторых химических элементов, находящихся в основном состоянии.
На первом месте в таблице Д.И.Менделеева стоит водород, атом которого имеет единственный электрон с произвольной ориентацией спина в 1s- состоянии ( n=1, l=0, m=0).
Атом гелия ( He, Z=2), стоящей на втором месте, имеет в 1s - состоянии два электрона, отличающихся ориентацией спинов 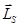 , то есть значениями квантового числа
, то есть значениями квантового числа 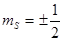 .
.
Атомом He завершается заполнение К-слоя, что соответствует завершению I периода системы Менделеева. Следующий, II период системы начинается с щелочного металла лития(Li, Z=3), третий электрон которого вынужден занять состояние 2S в L- слое (n=2, l=0,mе=0).
Атом бериллия (Ве, Z=4) имеет полностью заполненные состояния 1s и 2s.
У следующих шести элементов - от бора (В, Z=5) до неона (Ne,Z=10) - идет заполнение электронами очередного энергетического 2р-состояния (n=2, l=1). Инертный газ неон завершает II период таблицы Менделеева, он имеет целиком застроенный К-слой (два электрона) и L -слой (восемь электронов).
С щелочного натрия (Nа, Z=1) осуществляется последовательное заполнение состояний 3s и 3р М-слоя вплоть до инертного газа аргона (Аr, Z=18), завершающего III период таблицы Менделеева.
Нарушение описанного порядка заполнения квантовых состояний начинается с атома калия (К, Z=19), девятнадцатый электрон которого размещается не в М-слое
(в 3d -состоянии), а в следующем N-слое (в 4s-состоянии). Лишь после заполнения 4S-состояния (у кальция) начинается достройка пропущенного в 3d -состояния (у скандия). Все элементы, у которых заполняется внутреннее 3d -состояние при наличии электронов во внешнем валентном 4s-состоянии имеют близкие химические свойства (переходные металлы IV периода Периодической системы).
Очень близкими химическими свойствами обладают редкоземельные элементы (Z=58-71), атомы этих элементов отличаются заполнением внутреннего состояния при неизменных наружных оболочках. Актиниды (Z=90-103) тоже весьма близки по химическим свойствам: они отличаются застройкой внутреннего 5f-состояния при сохранении наружных оболочек.
Таким образом, периодичность химических свойств электронов объясняется повторяемостью электронных конфигураций во внешних электронных оболочках у атомов родственных элементов. Так, щелочные металлы (Li,К, Nа и т.д.) имеют во внешней оболочке лишь один валентный s-электрон, щелочно-земельные металлы (Ве,Мg, Са и т.д.) - два s-электрона, у благородных (инертных) газов (Не, Ne, Аr,Кr, Xe, Rn) наружная (s-р оболочка состоит из восьми электронов, образующих прочно связанную систему, а у активных неметаллов-галоидов (F, Cl, Br,…) в наружной
s-р оболочке недостает до полной застройки одного электрона, который может быть легко присоединен.
Дата добавления: 2015-07-24; просмотров: 950;
