КВАНТОВЫЕ ЧИСЛА
Потенциальная энергия электростатического взаимодействия электрона и протона (ядра атома водорода) зависит только от расстояния r между ними:
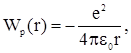 (2.64)
(2.64)
где е – заряд электрона.
С учетом (2.64) уравнение Шредингера для стационарного состояния атома водорода имеет вид:
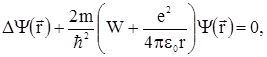 (2.65)
(2.65)
где 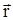 =
= 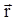 (x, y, z), причем
(x, y, z), причем 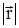 =
= 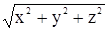 .
.
Функцию (2.64) можно представить графически в виде кулоновской потенциальной ямы, сечение которой изображено на рис.2.13.
Рис.2.13
Поскольку поле сферически симметрично, то уравнение (2.65) лучше записать в сферических координатах с центром на ядре (рис.2.14). Они связаны с декартовыми координатами соотношениями:

 х = r×sinQ×cosj,
х = r×sinQ×cosj,
y = r×sinQ×sinj,
z = r×cosQ,
где Q - полярный угол,
j - азимутальный угол.
Рис.2.14
Выразить оператор Лапласа D в сферических координатах довольно просто, но нужно выполнить громоздкие выкладки, поэтому запишем сразу окончательный результат:
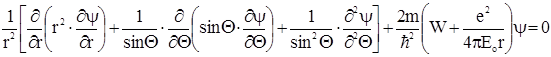 (2.66)
(2.66)
Это уравнение имеет физически осмысленные решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции в двух случаях:
- при любых положительных значениях полной энергии (W>0) электрона, что соответствует свободному состоянию электрона (ионизация атома) – заштрихованная область на рис.2.13.
- при дискретных отрицательных значениях полной энергии (Wn<0), соответствующих связанному состоянию электрона в потенциальном поле ядра, причем
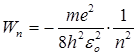 , (2.67)
, (2.67)
где n = 1,2,3,… - главное квантовое число.
С ростом числа n энергетические уровни дискретного спектра сгущаются; предельному значению n соответствует энергия W¥=0, отделяющая дискретный спектр от непрерывного (см.рис.2.13).
Выражение (2.67) совпадает с формулой (2.8), полученной Н.Бором
(см. п 2.1.3). Однако, в квантовой механике дискретность энергии не постулируется, а следует непосредственно из решения уравнения (2.66). Вследствие трехмерного характера задачи волновая функция электрона в этом уравнении в общем случае будет зависеть от всех трех координат, то есть y = ψ(r, Q, j), поэтому квантовые состояния электрона имеющие физический смысл , будут определяться не одним, а тремя квантовыми числами: главным –n, орбитальным – l и магнитным – mе.
Главное квантовое число определяет энергию электрона в соответствующем состоянии атома водорода согласно формуле (2.67).
Для любого n дифференциальное уравнение (2.66) имеет n линейно независимых решений (n волновых функций), которые можно классифицировать с помощью квантового числа l .
Орбитальное квантовое число l определяет модуль вектора механического орбитального момента импульса 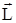 электрона в атоме:
электрона в атоме:
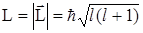 . (2.68)
. (2.68)
Число l характеризует пространственную симметрию волновой функции электрона. Например, все ψ - функции, соответствующие значению l = 0, сферически симметричны. При данном n число l может принимать значения от 0 до (n – 1), то есть всего n значений:
l = 0,1,2,…,(n –1). (2.69)
Для каждой пары чисел (n, l) уравнение (2.66) имеет (2l+1) линейно независимых решений, которые классифицируются с помощью магнитного квантового числа mе.
Магнитное орбитальное квантовое число ml определяет разрешенные значения проекции вектора 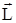 на выделенное направление Z в пространстве (например, на направление магнитного поля):
на выделенное направление Z в пространстве (например, на направление магнитного поля):
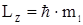 . (2.70)
. (2.70)
Зависимость ψ - функции от числа ml возникает, если, например, атом находится во внешнем магнитном поле или, если магнитное поле порождается движением ядра и остальных электронов (в водородоподобном атоме).
Магнитное квантовое число принимает следующие значения:
ml =0, ±1, ±2, ±3, …, ±l, (2.71)
поэтому угол между осью Z и вектором орбитального момента 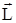 может принимать лишь определенные величины и никогда не бывает равным нулю (всегда
может принимать лишь определенные величины и никогда не бывает равным нулю (всегда 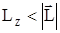 )
)
Например, если l = 2, то L = 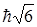 , то проекция
, то проекция 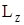 может иметь пять дискретных значений: (-2
может иметь пять дискретных значений: (-2  , -
, -  , 0, +
, 0, +  , +2
, +2  ) (см.рис.2.15).
) (см.рис.2.15).

Рис.2.15
Таким образом, атом водорода может иметь одно и то же значение энергии Wn, находясь в нескольких разных квантовых состояниях, отличающихся величиной и направлением момента импульса 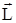 электрона, то есть значениями квантовых чисел l и ml. Эти состояния называются вырожденными. Число разных состояний для данного W называется кратностью g вырождения энергетического уровня:
электрона, то есть значениями квантовых чисел l и ml. Эти состояния называются вырожденными. Число разных состояний для данного W называется кратностью g вырождения энергетического уровня:
g 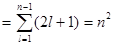 . (2.72)
. (2.72)
Дата добавления: 2015-07-24; просмотров: 1046;
