Физико-химические свойства аминокислот
В молекуле аминокислоты одновременно присутствуют две функциональные группы противоположного химического характера: основная (-NH2 - аминогруппа) и кислотная (-COOH - карбоксильная группа).
Эти группы способны к взаимодействию друг с другом, т. е. внутримолекулярной нейтрализации. Протон (Н+) карбоксильной группы может перейти на неподеленную электронную пару атома азота аминогруппы. В связи с этим аминокислоты правильнее представлять в виде так называемых внутренних солей типа (Рис. 1.7):
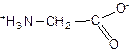
Рис. 1.7. α-Аминокислота в форме внутренней соли
Эта особенность определяет физические свойства аминокислот. Подобно неорганическим солям, аминокислоты – твердые, кристаллические вещества, растворимые в воде и мало растворимые в органических растворителях. Некоторые аминокислоты обладают сладким вкусом.
1.5.2.1. Кислотно-основное равновесие в растворе α-аминокислот
α-Аминокислоты обладают как минимум двумя ионогеннными группами (группами, которые при диссоциации образуют ионы) - карбоксилом и аминогруппой:

Рис. 1.8. Кислотно-основное равновесие в растворе α-аминокислот
В сильно кислой среде α-аминокислоты существуют в виде двухосновной кислоты (Рис. 1.8). В сильно щелочной среде будет преобладать анион.
В нейтральных средах могут присутствовать две незаряженные формы - нейтральная и биполярная (последнюю часто называют цвиттер-ионом).
α-Аминокислоты при нейтральных значениях рН существуют практически полностью в виде цвиттер-иона.
Характеристическое значение рH, при котором концентрация цвиттер-иона максимальна, называют изоэлектрической точкой (pI). Поскольку в целом молекула цвиттер-иона электронейтральна, электропроводность раствора в такой точке будет минимальной, а молекула аминокислоты не будет смещаться в электрическом поле.
Дата добавления: 2015-07-22; просмотров: 1591;
