Пептидная связь. Структура пептидной связи
В определенных условиях (например, при воздействии определенных ферментов), аминокислоты способны реагировать друг с другом. В результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислотывозникаетпептидная связь.
Образование пептидной связи можно представить себе, как отщепление молекулы воды от присоединяющихся к друг другу карбоксильной и аминогрупп (Рис. 1.9):

Рис. 1.9 Образование пептидной с вязи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм, что является средним значением между истинной одинарной связью C-N (0.149 нм) и истинной двойной связью C=N (0,127 нм). По некоторым данным, пептидная связь является частично двойной и частично одинарной:
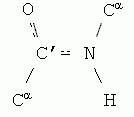
Рис 1.10. Пептидная связь
Пептидная связь имеет плоскую структуру(планарная связь), т. е. все четыре атома (C, N, O, H) лежат в одной плоскости, и характеризуется определённой жёсткостью, т. е..
Эти свойства пептидной связи обеспечиваются так называемой sp2-гибридизацией электронов N и С' атомов,отсутствием вращения вокруг C´-N связи
Давайте более подробно остановимся на тонкой (электронной) структуре пептидной связи.
Электронные формулы C, N и O:
Углерод, азот и кислород относятся ко 2-му периоду, т. е. имеют два энергетических уровня. На втором (внешнем) энергетическом уровне локализованы два энергетических подуровня: s и p.Электронные формулы этих элементов имеют следующий вид:
Углерод C 1s2 2s2 2p2
Азот N 1s2 2s2 2p3
Кислород O 1s2 2s2 2p4
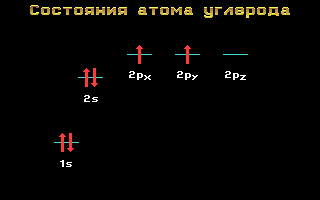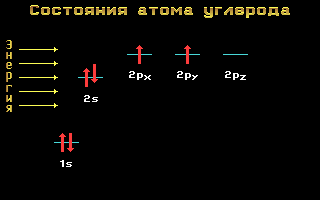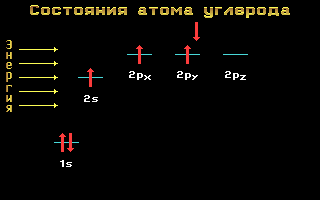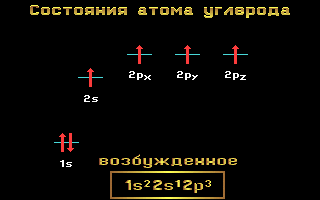
Рис. 1.11 Энергетические уровни атома углерода
Образованию ковалентной пептидной связи предшествует sp2-гибридизация атомных орбит атомов углерода и азота.

Рис. 1.12 sp2 гибридизация
sp2-гибридизация преобразует одну сферическую s- и две вытянутые p-орбиты электронов атома в три sp2-орбиты. Эти три орбиты вовлекают атом в три ковалентные связи, лежащие в одной плоскости.
Вовлеченные в sp2-гибридизацию электроны ковалентно связанных C' и N атомов создают "делокализованное" электронное облако, охватывающее оба эти атома, и распространяющиеся также — через связь С-О — на атом О (именно поэтому связи C'=N и C=O рисуются как равноправные "полуторные").

Рис. 1.13 Делокализация ковалентной связи при образовании пептидной связи
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь – связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов. Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Рассредоточение электронов – энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации р-электронов является π-перекрывание р-атомных орбиталей соседних sp2-атомов.
Однако у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp2 орбитах. И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp2-орбитам, то дополнительная связь этих p-электронов — связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов, - это обобществление p-электронов препятствует вращению вокруг С'-N связи.
Атом кислорода карбоксильной группы и атом водорода аминогруппы могут находятся в цис- или транс-положении относительно связи –C-N-.
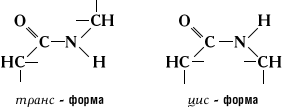
Рис. 1.14 Цис- и транс-форма пептидной связи
Экспериментально доказана большая устойчивость транс-формы.
Дата добавления: 2015-07-22; просмотров: 4991;
