Теории электродной поляризации
Первая теория электродной поляризации была разработана Нернстом в конце XIX - начале XX вв.
В соответствии с теорией Нернста электродный потенциал электрода как находящегося в равновесных условиях, так и под током, выражается одним и тем же уравнением. Например, потенциал электрода 1-го рода выражается уравнением:
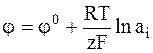 .
.
Термодинамическую активность иона аi можно выразить через молярную концентрацию Сi и коэффициент активности fi:
ai = fiCi
и уравнению для электродного потенциала можно придать следующий вид:
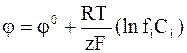 .
.
Для сравнительно невысоких концентраций коэффициент активности можно принять постоянным и включить 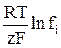 вместе со стандартным электродным потенциалом в общую константу:
вместе со стандартным электродным потенциалом в общую константу:
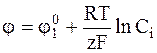 . (6 - 9)
. (6 - 9)
Так как для электрода, находящегося в равновесных условиях и под током, используется одно и то же уравнение, то из условий (6 - 7) и (6 - 8) следует, что вблизи поверхности электрода должны также выполняться следующие условия:
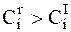 для катода; (6 - 10)
для катода; (6 - 10)
 для анода, (6 - 11)
для анода, (6 - 11)
где 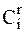 - концентрация ионов вблизи электрода при равновесных условиях,
- концентрация ионов вблизи электрода при равновесных условиях, 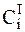 - концентрация ионов вблизи электрода, находящегося под током.
- концентрация ионов вблизи электрода, находящегося под током.
Соотношения (6 - 10) и (6 - 11) непосредственно вытекают из основного уравнения электродной поляризации:
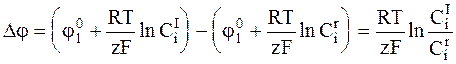 . (6 - 12)
. (6 - 12)
| Потенциал электрода под током | Равновесный потенциал электрода |
Нернст предложил метод расчета концентрации ионов вблизи электрода, находящегося под током ( 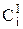 ). Суть этого метода можно продемонстрировать на примере процессов, протекающих в следующей электрохимической системе:
). Суть этого метода можно продемонстрировать на примере процессов, протекающих в следующей электрохимической системе:
M½Mz+, Ax−½M.
Если через раствор за время t проходит количество электричества, равное 1 фарадею, то на катоде разряжается 1 моль эквивалентов, а сила тока составит:
 .
.
При числе переноса ионов Mz+, равном t+, в этих условиях электрический ток доставит к катоду t+ моль эквивалентов катионов. Скорости разряжения ионов на катоде и их доставки окажутся равными соответственно:
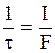 - скорость разряжения ионов на катоде;
- скорость разряжения ионов на катоде;
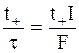 - скорость доставки ионов к катоду.
- скорость доставки ионов к катоду.
Так как скорость доставки ионов электрическим током меньше скорости, с которой они разряжаются на катоде, то в прикатодном пространстве возникает дефицит катионов. Скорость возрастания дефицита равна 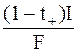 .
.
В стационарных условиях дефицитообразование, вызванное различиями скоростей выделения и доставки ионов, должно компенсироваться каким-либо другим процессом. Нернст предположил, что таким процессом является диффузия. В связи с этим его теория получила название диффузионной теории поляризации.
Диффузионный поток ионов определяется законом Фика. В предположении, что в прикатодном пространстве (оно рассматривается как имеющее толщину d порядка молекулярных размеров) концентрация ионов с расстоянием от катода изменяется линейно, а градиент концентрации можно представить следующим образом:
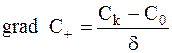 ,
,
где Сk - молярная концентрация катионов вблизи катода, C0 - молярная концентрация ионов в объеме раствора (вне прикатодного пространства).
Диффузионный поток ионов, коэффициент диффузии которых равен D+, к катоду, имеющему площадь S, в соответствии с законом Фика равен:
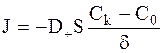 .
.
Для потока, выражаемого числом моль эквивалентов, определяющих переносимый заряд, можно записать:
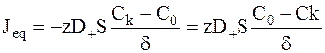 .
.
Следовательно, для стационарных условий выполняется равенство:
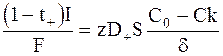 . (6 - 13)
. (6 - 13)
Концентрация ионов Mz+ вблизи катода равна:
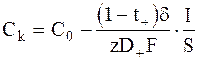 . (6 - 14)
. (6 - 14)
Объединив все постоянные, включая число переноса, коэффициент диффузии и толщину приэлектродного слоя, в одну константу k и принимая во внимание, что отношение силы тока к площади электрода представляет собой плотность тока i, получим:
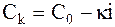 . (6 - 15)
. (6 - 15)
С учетом выражения (6 - 15) запишем уравнение для катодной поляризации:
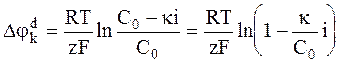 . (6 - 16)
. (6 - 16)
В отличие от катодной поляризации анодная поляризация сопровождается избыточным (по сравнению с транспортируемым током) переходом ионов в раствор. В связи с этим диффузионный поток приводит к отводу ионов от анода, то есть имеет противоположное направление. В связи с этим для анодной поляризации должно выполняться уравнение:
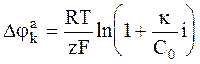 . (6 - 17)
. (6 - 17)
Из уравнения (6 - 16) следует, что для катодной поляризации должен существовать предел плотности тока, который равен:
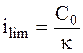 . (6 - 18)
. (6 - 18)
С учетом равенства (6 - 18) уравнение для катодной поляризации принимает следующий вид:
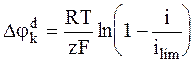 . (6 - 19)
. (6 - 19)
Если процесс растворения анода не сопровождается другими явлениями, анодная поляризация не должна иметь предельного тока.
Уравнения (6 - 16) - (6 - 19) позволяют понять, каким образом можно экспериментально изучать поляризацию отдельных электродов. Действительно, если площадь одного из двух электродов во много раз больше площади другого, то на электроде с большей площадью плотность тока будет настолько мала, что поляризацией его можно пренебречь. В этом случае ЭДС поляризации окажется равной поляризации электрода с меньшей площадью.
Явление поляризации лежит в основе важного электрохимического метода анализа - полярографии.
В заключение отметим, что еще одной причиной поляризации электродов может служить замедление присоединения электронов к ионам или отрыва электронов от атомов.
Дата добавления: 2015-07-22; просмотров: 1070;
